закрытие ИП
Нелепая история приключилась с индивидуальным предпринимателем, который решил закрыть свой бизнес.
ИП заполнил бланк формы Р26001 и лично сдал его в ИФНС. Так как бизнесмен не помнил свои номера (ИНН и ОГРН), а под рукой бумажных документов с их указанием не оказалось, он воспользовался сервисом ФНС. На сайте ФНС он забил свои ФИО, и получил желаемые коды.
Налоговики благополучно закрыли ИП.
Дело было в апреле 2019-го. Каково же было изумление бывшего ИП, когда в январе 2020-го он получил требование об уплате взносов за 2019 год.
Выяснилось, что он до сих пор числится действующим предпринимателем и ему начисляются взносы.
Оказывается, случился курьез. ИП по ошибки заполнил форму Р26001 на своего полного тезку. В итоге налоговики прикрыли бизнес не того человека.
Этой историей ИП поделился на нашем форуме в теме «ФНС прекратила деятельность ИП однофамильца!».Мужчина упрекает налоговиков в невнимательности — ведь они должны были проверить документы.
Теперь мужчине предстоит повторно пройти процедуру закрытия и заплатить взносы за тот период, когда он был ИП, будучи уверенным, что деятельность прекращена.
Такая перспектива его не радует. Но что поделать…
Добавим, что в еще более курьезной ситуации оказался другой ИП-однофамилец, которого исключили из ЕГРЮЛ против его воли.
«Еще спасибо скажите, что тот ИП, которого закрыли, на разборки не пришел, вот он хлебнул, наверное» — комментируют читатели форума.
В общем, ситуация со стороны выглядит комично. Помните, как там у Михаила Задорнова? А в это время проводница второго девятого вагона…
Правда, обоим ИП в этой истории не до смеха.
Будьте внимательны при заполнении документов!
Закрыть ИП через Госуслуги и на сайте ФНС РФ в интернете — пошаговая инструкция
Закрытие ИП — утомительная процедура, требующая посещения налоговой и простаивания в очередях.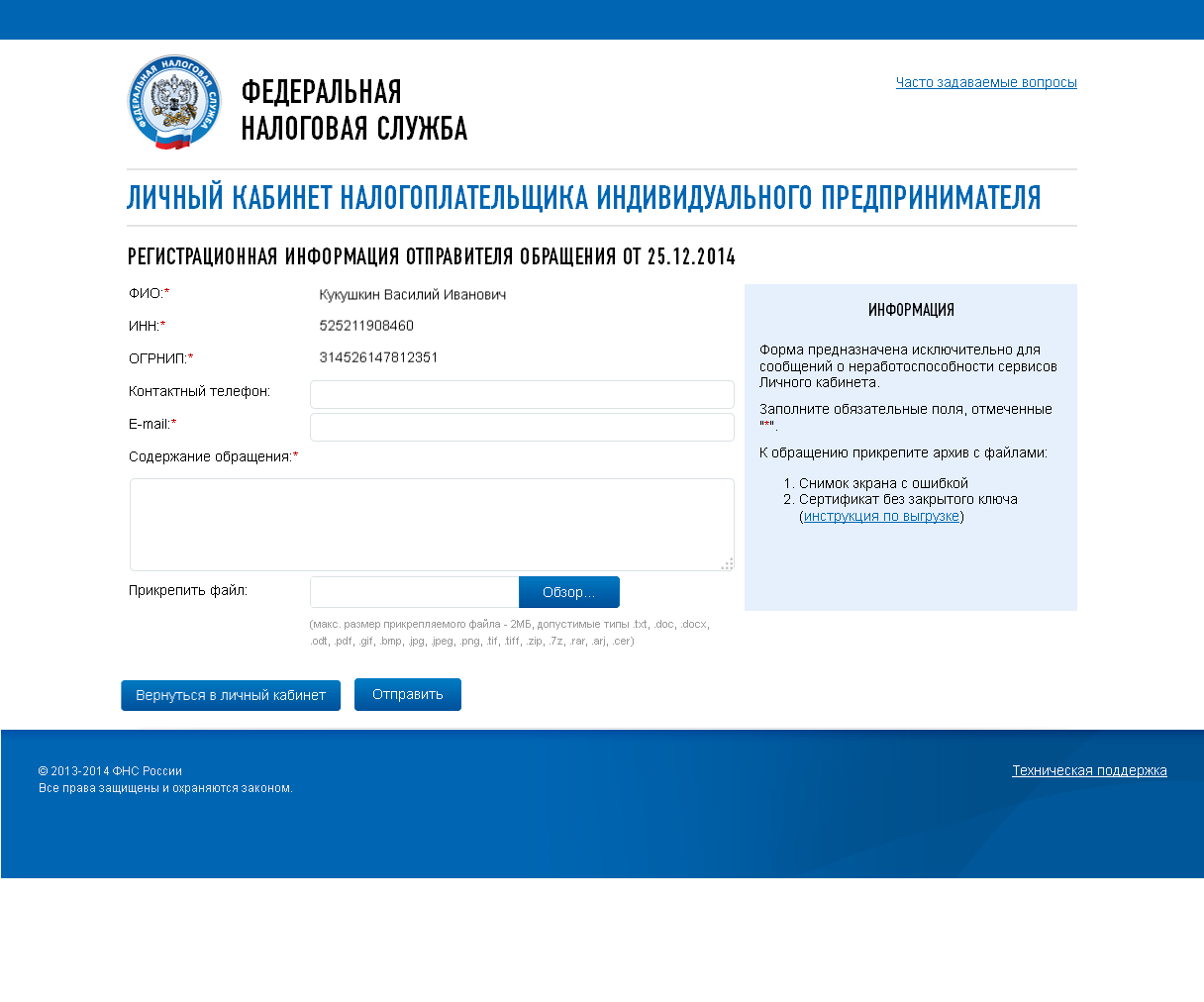 Электронные государственные сервисы предоставляют возможность упростить регистрацию прекращения деятельности и подать документы онлайн, прямо из дома.
Электронные государственные сервисы предоставляют возможность упростить регистрацию прекращения деятельности и подать документы онлайн, прямо из дома.
Что сделать перед закрытием
Прекратить деятельность в качестве индивидуального предпринимателя вы можете без личного обращения в налоговую, но предварительно придётся выполнить ряд формальных мероприятий.
Обязательно сдайте отчётность в налоговую и внебюджетные фонды, а также:
- в течение 15 дней после сдачи отчётности заплатите обязательные взносы в ПФР и ФОМС;
- заплатите налоги согласно срокам по вашей системе налогообложения;
- снимите фирму с учёта в фонде социального страхования, предварительно рассчитавшись финансово и сдав форму 4-ФСС;
- за 2 недели уведомите Центр занятости населения о грядущем увольнении сотрудников;
- оформите приказы об увольнении;
- снимите с учёта кассовый аппарат, обратившись в обслуживающую компанию;
- закройте расчётные счета в банках.
Подготовьте документы для закрытия ИП:
Бланк Р26001 состоит из одной страницы, куда предприниматель вписывает все данные
Выполнив перечисленные действия и убедившись, что у вас нет задолженностей, можете закрывать ИП. Дистанционно прекратить работу в качестве предпринимателя можно на сайте налоговой службы (ФНС) с помощью официального портала госуслуг РФ.
Электронная подпись для закрытия ИП
При отправке документов о прекращении деятельности через интернет вам понадобится электронная цифровая подпись (ЭЦП) для верификации личности. ЭЦП — электронный ключ, в котором закодирована ваша подпись в цифровом виде.
Подпись оформляется всегда для конкретного физлица и может быть трёх видов:
- простая — подтверждает, что документ отправили вы, практически не используется;
- неквалифицированная усиленная — подтверждает, что документ не изменялся с момента подписания;
- квалифицированная усиленная — приравнивается к обычной подписи.
Закрыть ИП онлайн вы сможете только при наличии персональной квалифицированной усиленной подписи, имеющей юридическую силу.
Носитель электронной подписи внешне не отличается от обычной флешки
Заранее оформите ЭЦП в аккредитованном удостоверяющем центре. Список центров посмотрите на сайте Минкомсвязи и выберите ближайший. Соберите документы:
- оригинал паспорта;
- заверенную в нотариальной конторе копию паспорта;
- СНИЛС;
- ИНН и ОГРН.
Напишите заявление на выдачу электронного ключа по форме, предусмотренной удостоверяющим центром, и оплатите услугу. Квитанцию вам выдадут сотрудники центра. Стоимость ЭЦП зависит от расценок удостоверяющей организации и варьируется от 1 до 3 тыс. р. Если вам некогда получать подпись самостоятельно, оформите и заверьте доверенность на представителя.
Как закрыть ИП через сайты ФНС и Госуслуги: порядок действий
Портал госуслуг позволяет зарегистрированным пользователям взаимодействовать с органами власти и бюджетными структурами дистанционно не выходя из дома. Услуга закрытия ИП, хотя и входит в каталог, не является электронной. Поэтому регистрация на портале понадобится вам только для последующего входа на сайт ФНС.
Порядок регистрации на портале госуслуг
Пройдите регистрацию на портале госуслуг, чтобы воспользоваться личным кабинетом на сайте налоговой.
Порядок действий для регистрации:
- Перейдите на сайт gosuslugi.ru.
- Найдите поле для входа и нажмите «Зарегистрироваться».
Регистрация на портале Госуслуг также возможна при обращении в многофункциональный центр, сотрудники которого помогут преодолеть технические сложности
- Укажите свои данные: имя, фамилию, телефон и адрес электронной почты.
В регистрационной форме нужно заполнить все поля
- Нажмите кнопку «Зарегистрироваться».
- На указанный номер поступит СМС с паролем для подтверждения.
- Введите пароль в открывшееся поле и нажмите «Продолжить».
Указывайте верный номер телефона — на него поступит код подтверждения, который нужно ввести на сайте
- Заполните информацию профиля: Ф.
 И. О., пол, дату и место рождения, данные паспорта или загранпаспорта, номер СНИЛС. Нажмите «Сохранить и продолжить».
И. О., пол, дату и место рождения, данные паспорта или загранпаспорта, номер СНИЛС. Нажмите «Сохранить и продолжить». - Система проверит введённые данные в течение 15 минут и отправит вам уведомление на электронную почту.
Окно проверки данных можно закрыть — операция все равно будет завершена
- После проверки подтвердите электронную почту: зайдите в почтовый ящик и откройте письмо с сообщением о регистрации на портале, а затем пройдите по ссылке подтверждения, указанной в письме.
- После верификации электронной почты и проверки данных ваша учётная запись получит статус стандартной. Но для закрытия ИП требуется подтверждённая запись. Если вы уже оформили ЭЦП, воспользуйтесь электронным ключом, чтобы пройти верификацию. Выберите соответствующий пункт и установите носитель с ключом в компьютер.
Вы можете выбрать удобный вариант для подтверждения личности — по почте, лично или с помощью электронной подписи
- Дождитесь подтверждения.
После проверки данных ваша учетная запись получит статус подтвержденной
Другие способы подтверждения личности, не требующие наличия ЭЦП — в ближайшем многофункциональном центре или центре обслуживания. Туда нужно обратиться лично с паспортом и СНИЛС и написать заявление — в течение 5–10 минут специалист выдаст конверт с уникальным ключом подтверждения.
Если верификация прошла успешно, вам станет доступен полный каталог услуг для физлиц. Чтобы получить доступ к услугам для ИП, добавьте в профиль информацию о компании:
- Зайдите в личный кабинет и нажмите на учётную запись.
- Выберите «Мои организации».
- Введите ИНН и ОГРНИП и дождитесь подтверждения системы.
Информацию об ИП при необходимости можно удалить из личного кабинета на сайте Госуслуг вручную
После верификации вы увидите страницу с информацией о добавленном ИП.
Видео: как пройти регистрацию на портале госуслуг
Регистрация на сайте налоговой в качестве предпринимателя
После регистрации на портале госуслуг в качестве физлица вы можете заходить на сайт ФНС без регистрации. Но чтобы получить доступ к личному кабинету ИП, придётся сходить в налоговую с учредительными документами — ИНН, ОГРНИП, и получить уникальный код подтверждения. Доступ будет открыт в течение 1–3 дней.
Но чтобы получить доступ к личному кабинету ИП, придётся сходить в налоговую с учредительными документами — ИНН, ОГРНИП, и получить уникальный код подтверждения. Доступ будет открыт в течение 1–3 дней.
Как открыть личный кабинет ИП:
- Зайдите на сайт налоговой службы.
- Выберите пункт «Физические лица — зайти в личный кабинет».
Войти в личный кабинет предпринимателя можно с помощью подтвержденной учетной записи физического лица на Госуслугах
- Нажмите «Вход с помощью учетной записи портала госуслуг».
После перехода на сайт Госуслуг введите логин и пароль от учетной записи — система автоматически вернет вас к сервисам ФНС
- Вы будете перенаправлены на страницу входа на сайт «Госуслуги». Введите данные для входа.
- Система направит вас обратно на сайт налоговой службы в кабинет физлица.
- В правом верхнем углу вы увидите ссылку «Личный кабинет ИП» — нажмите на неё.
Для перехода в личный кабинет ИП из кабинета физлица на сайте ФНС достаточно нажать одну кнопку
Вы увидите все доступные для предпринимателя сервисы, в том числе услугу по закрытию бизнеса. Выберите сервис «Подача документов на регистрацию юридических лиц и ИП» и по предложенным ссылкам скачайте две программы: «Подготовка пакета документов для госрегистрации» и «Программа подготовки электронных документов».
Подготовка и отправка документов
Установив программы, откройте ту, что предназначена для автоматического заполнения документов («Программа подготовки электронных документов»). Выберите и заполните нужное заявление. Как это сделать:
- Установите носитель с электронной подписью в компьютер.
- Откройте программу и нажмите «Новый документ».
- Выберите тип документа — заявление Р26001.
В программе для подготовки документов в ФНС можно заполнить не только заявление на закрытие ИП, но и ряд других документов
- Введите данные о предпринимателе — ОГРНИП, ИНН, ФИО, контакты. Выберите, каким образом хотите получить решение о закрытии ИП.

Обязательно укажите способ получения готового комплекта документов — если вы не торопитесь, удобнее получить его по почте
- Нажмите на кнопку «Печать» и сохраните заявление в формате tiff (многостраничный файл).
- Закройте окошко печати и нажмите на кнопку с конвертом «Формирование пакета». Вы будете автоматически перенаправлены во вторую программу – «Подготовка пакета документов для государственной регистрации».
После сохранения электронного заявления Р26001 его нужно подписать
- В открывшемся окне выберите инспекцию, куда будете направлять документы, а также укажите путь к сохранённому файлу с заявлением. Аналогичным образом добавьте скан квитанции об оплате госпошлины. Затем нажмите «Выбрать ЭЦП».
Убедитесь, что действующий ключ электронной подписи установлен в компьютер, перед тем как выбирать ЭЦП в программе
- Выберите ключ ЭЦП и нажмите «Применить», а затем – «Подписать».
- Подписав документы, нажмите «Сформировать».
Кнопка «Сформировать» завершает процедуру подготовки документов для налоговой
Госпошлину за закрытие ИП тоже можно заплатить онлайн, выбрав соответствующий пункт в разделе «Уплата госпошлины» на сайте налоговой.
Сформированный пакет подписанных документов загрузите на сайт ФНС в раздел «Сервисы — Подача документов на регистрацию юрлиц и ИП» — обязательно через браузер Internet Explorer. Уведомление о приёме заявки в работу поступит в течение суток.
Порядок получения ответа от ФНС
Срок рассмотрения заявления — 5 рабочих дней, по окончании вы получите уведомление о регистрации прекращения деятельности либо об отказе в закрытии ИП.
Основания, по которым налоговая инспекция может отказать в закрытии бизнеса:
- неполный комплект документов, указаны недостоверные данные;
- документы направлены в ненадлежащий налоговый орган;
- заявление подписано неуполномоченным лицом;
- не сдана отчётность, не уплачены налоги;
- есть решение суда, запрещающее закрывать ИП.

В случае отказа вам направят документ с указанием конкретной причины. Устранив причину отказа, вы сможете добиться от инспекторов положительного решения о прекращении предпринимательской деятельности.
После закрытия ИП налоговая сформирует документ о внесении соответствующей записи в ЕГРИП. Если в заявлении вы указали, что хотите получить итоговый комплект документов по почте, то сотрудники инспекции направят их вам. Если нет, придётся обращаться в налоговую лично с паспортом и забирать свидетельство.
Преимущества и недостатки закрытия ИП через интернет
Главное преимущество закрытия ИП через интернет в том, что вам не нужно стоять в очереди, общаться с инспекторами, по несколько раз заполнять документы из-за ошибок в оформлении. Другие плюсы:
- можно оформить документы самостоятельно и не тратить деньги на консультации и дополнительные услуги в сторонних фирмах;
- минимальный шанс допустить ошибку в заявлении — программы автозаполнения документов предупреждают о возможных неточностях.
Единственный недостаток — невозможность заказать услугу без электронной подписи.
С развитием электронных сервисов взаимодействие с государственными органами упрощается, снижается объем бумажной работы. Закрытие ИП онлайн — достойная альтернатива личному обращению в налоговую службу.
Я веду собственное дело и понимаю, как непросто решиться на открытие фирмы. Поэтому создаю информативные статьи о бизнесе, которые помогают вникнуть в суть организации процесса. А в качестве хобби пишу о путешествиях, животных, а также о работе различных гаджетов и компьютерных программ. Оцените статью: Поделитесь с друзьями!Способы подачи заявления на ликвидацию ИП
Онлайн
В сервисе «Документовед» можно подготовить документы для электронной подачи.
Для этого нужно заполнить анкету на Ликвидацию ИП.
После отправляем заявку на формирование контейнера. Наши специалисты формируют для вас контейнер для ликвидации ИП.
Наши специалисты формируют для вас контейнер для ликвидации ИП.
Скачайте контейнер в личном кабинете и откройте на компьютере, где установлен сертификат квалифицированной электронной подписи. Откройте файл и нажмите две кнопки: «Подписать» и «Отправить».
Заявление отправляется в налоговую и в течение следующего дня должна прийти расписка.
Получение документов
Ликвидацию ИП налоговая зарегистрирует в течение 5 рабочих дней.
Лист записи о прекращении деятельности индивидуального предпринимателя ФНС отправит на электронную почту, указанную в форме Р26001. Он будет подписан ЭЦП налогового органа и в соответствии с Федеральным законом № 63-ФЗ «Об электронной подписи» равнозначен документу с проставленной синей печатью.
При желании Вы можете получить лист записи в ЕГРИП на бумажном носителе способом доставки, указанном в заявлении (лично либо почтой).
Преимущества и недостатки онлайн подачи
Основные плюсы электронной подачи через сервис «Документовед»:
- Без личного посещения налоговой инспекции.
- Можно подать документы, не выходя из дома.
- Ваше местоположение не важно — заявление поступит в нужную налоговую инспекцию.
- Без оплаты государственной пошлины и услуг нотариуса.
Единственный недостаток данного способа — для онлайн подачи потребуется квалифицированная электронная подпись.
Лично
Уточните режим работы инспекции, а также нужна ли предварительная запись.
Важно! При личной подаче в ФНС не забудьте паспорт.
Если электронной записи нет, то по приходу в налоговую найдите окошко для приема заявления на ликвидацию, и займите очередь.
Проверьте пакет документов, необходимый для подачи:
- заполненная форма Р26001;
- квитанция на уплату пошлины;
- справка, подтверждающая представление сведений в ПФР (не обязательно).
Инспектор налоговой обязан принять все документы, попросить поставить в его присутствии подпись на форме Р26001 и выдать расписку.
На расписке будет указана дата готовности — через 5 рабочих дней со дня, следующего за днем подачи.
Если в Р26001 было отмечено личное получение, то с паспортом и распиской вернитесь в налоговую и получите лист записи в ЕГРИП. Если отметили получение по почте — документ, подтверждающий закрытие ИП, будет отправлен на домашний адрес.
Преимущества и недостатки личной подачи в ФНС
Из преимуществ можно отметить отсутствие необходимости заверения формы, оформления доверенности. Также этот способ надежнее отправки заявления по почте.
Но есть ряд существенных недостатков:
- существенная потеря времени на посещение налоговой;
- необходимо будет оплачивать государственную пошлину;
- часто регистрирующая налоговая находится на большом расстоянии от места жительства.
А если гражданин зарегистрирован в одном регионе, а проживает совсем в другом месте, и у него нет возможности доехать до нужной налоговой. Тогда единственным вариантом будут удаленные способы подачи документов.
МФЦ
Прежде чем подавать документы на закрытие ИП в МФЦ, нужно выяснить, в каком из них это можно сделать — такая услуга есть не во всех центрах государственных услуг.
При посещении МФЦ не забудьте взять с собой паспорт!
В присутствии специалиста МФЦ поставьте подпись на заявлении Р26001 и получите расписку.
Срок регистрации ликвидации при таком способе подачи немного увеличивается (7 рабочих дней), так как нужно пару дней для передачи документов из МФЦ в налоговую и обратно.
При получении результата ликвидации сотрудник МФЦ проверит Ваш паспорт и выдаст бумажный документ, подтверждающий содержание электронного листа записи.
Преимущества и недостатки личной подачи в МФЦ
Главный из недостатков — далеко не все центры государственных услуг могут предоставить данную услугу. Также предоставить заявление Вы можете не в любой МФЦ, а только по месту своего проживания.
По доверенности
При таком способе подачи нужно будет посетить нотариуса для заверения подписи в форме Р26001 и оформления доверенности.
Порядок подачи через представителя не отличается от личной подачи. Все действия по подаче и получению документов ложатся на плечи представителя.
Преимущества и недостатки подачи через представителя
Из преимуществ можно отметить отсутствие необходимости посещения налоговой лично Вами. В налоговую отправится Ваш представитель.
Основной недостаток — посещение нотариуса:
- Это может отнять много времени, так как чаще всего у нотариусов очередь, даже если Вы предварительно записывались.
- Стоимость нотариальных услуг. Заверение формы —1500 -2000 ₽, оформление доверенности —1500 -2000 ₽.
По почте
Для отправки по почте заявление Р26001 предварительно нужно будет заверить у нотариуса.
После отправляемся в любое почтовое отделение.
1. Заполняем конверт. На конверте внимательно вписываем:
- КОМУ: Наименование регистрирующего налогового органа и полный почтовый адрес;
- ОТ КОГО: Вписываем свой адрес, куда налоговый орган отправит расписку, а потом при положительном решении — документы, подтверждающие закрытие ИП.

2. Вкладываем в конверт необходимые бумаги.
3. Оформляем опись вложения в двух экземплярах.
4. Оформляем уведомление о вручении (обязательно регистрируемое).
5. Конверт с вложенными документами, опись вложения в двух экземплярах и заполненный бланк регистрируемого уведомления передаём оператору почтовой связи.
6. Предупреждаем оператора, что необходимо оформить отправление с объявленной ценность, описью вложения и уведомлением.
7. Оператор выдаст один экземпляр описи вложения и чек с трек-номером, для возможности отслеживания прохождения отправления на сайте ФГУП Почта России.
Получение документов
После того, как налоговая получит Ваше отправление, обработает его, отправит на указанный Вами адрес расписку.
Момент поступления заявления на закрытие ИП в налоговую Вы можете отслеживать по трек-номеру в чеке, который выдал оператор на почте.
В случае успешной регистрации, лист записи в ЕГРИП отправляют по почте, если Вы указали именно такой способ получения документов.
Преимущества и недостатки
Недостатков такого способа значительно больше.
Основной недостаток — расходы на заверение подписи в заявлении Р26001 (1500-2000 ₽).
Также необходимо будет оплатить почтовые услуги.
И самое важное, отправка почтой России — достаточно долгий и ненадежный способ закрытия ИП. Документы могут идти в налоговую около недели, а могут затеряться и до налоговой не дойти.
Как закрыть ИП – Первый городской бизнес-инкубатор
Второй обучающий ролик нашего эксперта Ольги Голосовой, генерального директора ООО «Юридическая компания «Вероника» посвящен вопросам закрытия ИП
Как закрыть ИП:
- Подготовить необходимый пакет документов:
- Заявление о государственной регистрации прекращения физическим лицом деятельности в качестве индивидуального предпринимателя в связи с принятием им решения о прекращении данной деятельности (форма № Р26001).
 Подпись на заявлении должна быть заверено в нотариальном порядке.
Подпись на заявлении должна быть заверено в нотариальном порядке. - Квитанция об уплате госпошлины
- Документ, подтверждающий представление сведений в территориальный орган Пенсионного фонда ( не обязательно) . Если заявитель не представит этот документ, нужную информацию территориальный орган Пенсионного фонда направит налоговому органу в электронном виде в рамках межведомственного обмена.
- Предоставить документы в налоговую инспекцию тремя возможными способами:
- Лично
- через представителя по нотариально удостоверенной доверенности;
- по почте с объявленной ценностью и описью вложения;
В Санкт-Петербурге необходимо подавать документы в Межрайонную инспекцию ФНС России № 15 по Санкт- Петербургу (Единый центр регистрации) по адресу 191124, Санкт-Петербург,ул. Красного Текстильщика, дом 10-12, литера “О”
- По истечении 8-ми дней заявитель может лично или через представителя получить свидетельство о прекращении предпринимательской деятельности (лист записи ЕГРИП)
В случае отказа в государственной регистрации вы получите документ, в котором изложена причина отказа.
Ранее без полного погашения долгов и предоставления в налоговую инспекцию справки из Пенсионного Фонда закрытие ИП не производилось. Теперь снятие ИП с учета возможно, даже если имеется задолженность. Долги будут числиться за вами уже как физическим лицом.
Также Вы можете ознакомиться с условиями закрытия ИП на сайте Федеральной налоговой службы: https://www.nalog.ru/rn77/ip/interest/termination_activities/want_stop/
Налоговая служба разрешила закрывать ИП не выходя из дома с помощью селфи
Упрощенная возможность ликвидации ИП предоставлена только на период действия ограничений из-за коронавируса.
Федеральная налоговая служба России доработала сервис «Государственная регистрация ЮЛ и ИП», в котором можно ликвидировать статус предпринимателя без личного посещения налоговой инспекции и не используя электронную подпись. Об этом сообщает Life.ru.
Об этом сообщает Life.ru.
Для этого достаточно сфотографировать или отправить скан-образ страниц паспорта с информацией о выдаче документа, его серии и номере. Далее человеку необходимо отправить собственное селфи с этим документом, открытым на соответствующих страницах.
В дальнейшем, налоговая направляет эти документы в регистрирующий орган. На это уходит, как правило пять дней.
По данным ФНС России, в марте закрылось на 77% больше ИП, нежели за тот же период прошлого года. 65 тысяч российских предпринимателей прекратили свою деятельность.
По мнению юриста Олега Мещерякова, это новшество помогает быстро избавиться от ИП не только тем, кто вынужден пока прекратить свой бизнес из-за ограничений в связи с распространением коронавируса, но и тем, кто в дальнейшем хочет сэкономить на налогах.
Олег Мещеряков считает, что налоговый режим для самозанятых более выгоден, чем статус ИП. Предпринимателю не нужно платить страховые взносы, считает юрист.
Кроме того, упрощенная возможность ликвидации статуса ИП предоставлена только на период действия ограничений из-за коронавируса.
Ранее телеканал «Санкт-Петербург» сообщал, прием граждан в налоговых инспекциях приостановлен до 30 апреля, в соответствии с указом президента от 2 апреля № 239 «О мерах по обеспечению санитарно-эпидемиологического благополучия населения на территории РФ в связи с распространением новой коронавирусной инфекции (COVID-19)».
Подписывайтесь на нас в «Яндекс.Новостях», Instagram и «ВКонтакте».
Читайте нас в Telegram.
Фото: телеканал «Санкт-Петербург»
Что делать с кассой при закрытии ИП: как снять онлайн-кассу с учета в налоговой
Нередко предприниматель задается вопросом, как закрыть онлайн-кассу при закрытии ИП? Что будет, если при закрытии ИП не списать кассу с регистрации в ФНС?
Снятие с регистрации кассы требуется не только, если деятельность прекращена, но и при продаже устройства, его хищении или потере. Как вообще происходит снятие кассы с регистрационного учета? Изначально, вся процедура по снятию с учета онлайн кассы была конкретизирована № 54 ФЗ (статье 4.2). Временные рамки снятия с учета онлайн-кассы не прописаны законодательством, однако отмечен момент, если касса продается или передается другому предпринимателю в пользование, а также в случае потери или кражи кассы – следует обратиться в налоговую службу в течение одного рабочего дня.
Как вообще происходит снятие кассы с регистрационного учета? Изначально, вся процедура по снятию с учета онлайн кассы была конкретизирована № 54 ФЗ (статье 4.2). Временные рамки снятия с учета онлайн-кассы не прописаны законодательством, однако отмечен момент, если касса продается или передается другому предпринимателю в пользование, а также в случае потери или кражи кассы – следует обратиться в налоговую службу в течение одного рабочего дня.
Как снять с учета онлайн-кассу? Два простых способа:
- обратиться в налоговую службу онлайн через личный кабинет налогоплательщика на сайте ФНС;
- лично посетить любое отделение налоговой инспекции.
При обращении в ФНС, налогоплательщик должен заполнить заявление о снятии кассы с регистрационного учета, которое должно содержать:
- ФИО владельца кассы;
- ИНН владельца кассы;
- полное наименование онлайн кассы;
- заводской номер онлайн кассы, который применялся при регистрации в ФНС;
- информацию о хищении или утрате онлайн кассы (если такое бывало).
Законодательством установлено, что ФНС обрабатывает заявление владельца кассы за десять рабочих дней, после чего выдает налогоплательщику карточку о снятии онлайн кассы с учета. Данная карточка отображает всю информацию, прописываемую в заявлении (ФИО, ИНН, полное наименование кассы и т.д.), и дату снятия контрольно-кассового устройства с учета. При этом если карточка была получена в электронном виде, налогоплательщик всегда может обратиться в налоговую службу за бумажной версией документа.
Помимо заявления о снятии с учета онлайн кассы в ФНС, следует направить и отчет о закрытии фискального накопителя, который обязателен во всех случаях, за исключением ситуаций: хищения онлайн кассы; неисправности из-за заводского брака; отсутствия технической возможности формирования отчета. При этом наличие технической неисправности необходимо документально подтвердить.
Следует отметить, что для предпринимателей, которые могут работать в офлайн режиме, без оперативной передачи фискальной информации ОФД, необходимо сохранить информацию со всех фискальных документов и передать ее в электронном виде в ФНС вместо отчета о закрытии накопителя.
Нужно ли снимать кассу с учета?
Итак, снятие кассы с регистрации является достаточно простым, но вместе с тем затратным по времени процессом. Следует ли снимать кассу с учета в налоговой службе, если предпринимательская деятельность уже прекращена?
В поправках №54-ФЗ, внесенных в 2018, имеется пункт, согласно которому при завершении предпринимательской деятельности ФНС снимает контрольно-кассовую технику с регистрационного учета самостоятельно, в одностороннем порядке. При этом, необходимость предоставления заявления и отчета о закрытии накопителя не отмечена в законодательстве. Проще говоря, теперь индивидуальный предприниматель может просто закрыть ИП, а ФНС автоматически снимет с учета его контрольно-кассовую технику. Данная поправка была принята в июле 2018 года, и направлена на улучшение условий для налогоплательщиков и сокращение бумажной волокиты. Однако эксперты все еще рекомендуют снимать кассы с учета через заявление, для подстраховки.
ФНС предложила лишать статуса ИП из-за долгов по налогам — Право на vc.ru
{«id»:40895,»url»:»https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»title»:»\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»services»:{«facebook»:{«url»:»https:\/\/www.facebook.com\/sharer\/sharer.php?u=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»short_name»:»FB»,»title»:»Facebook»,»width»:600,»height»:450},»vkontakte»:{«url»:»https:\/\/vk. com\/share.php?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&title=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»VK»,»title»:»\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,»width»:600,»height»:450},»twitter»:{«url»:»https:\/\/twitter.com\/intent\/tweet?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&text=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&text=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c&body=https:\/\/vc.
com\/share.php?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&title=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»VK»,»title»:»\u0412\u041a\u043e\u043d\u0442\u0430\u043a\u0442\u0435″,»width»:600,»height»:450},»twitter»:{«url»:»https:\/\/twitter.com\/intent\/tweet?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&text=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»TW»,»title»:»Twitter»,»width»:600,»height»:450},»telegram»:{«url»:»tg:\/\/msg_url?url=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam&text=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c»,»short_name»:»TG»,»title»:»Telegram»,»width»:600,»height»:450},»odnoklassniki»:{«url»:»http:\/\/connect.ok.ru\/dk?st.cmd=WidgetSharePreview&service=odnoklassniki&st.shareUrl=https:\/\/vc.ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»short_name»:»OK»,»title»:»\u041e\u0434\u043d\u043e\u043a\u043b\u0430\u0441\u0441\u043d\u0438\u043a\u0438″,»width»:600,»height»:450},»email»:{«url»:»mailto:?subject=\u0424\u041d\u0421 \u043f\u0440\u0435\u0434\u043b\u043e\u0436\u0438\u043b\u0430 \u043b\u0438\u0448\u0430\u0442\u044c \u0441\u0442\u0430\u0442\u0443\u0441\u0430 \u0418\u041f \u0438\u0437-\u0437\u0430 \u0434\u043e\u043b\u0433\u043e\u0432 \u043f\u043e \u043d\u0430\u043b\u043e\u0433\u0430\u043c&body=https:\/\/vc.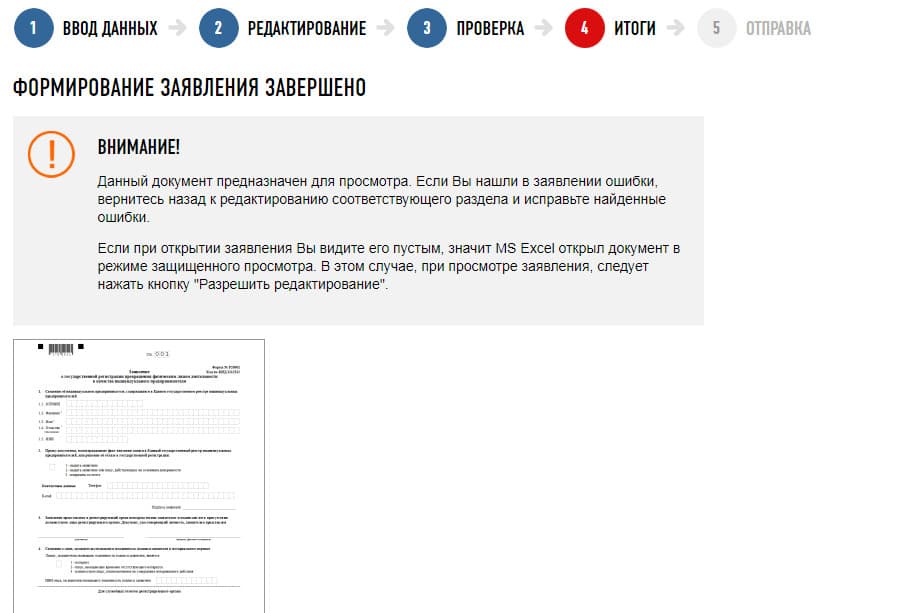 ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
ru\/legal\/40895-fns-predlozhila-lishat-statusa-ip-iz-za-dolgov-po-nalogam»,»short_name»:»Email»,»title»:»\u041e\u0442\u043f\u0440\u0430\u0432\u0438\u0442\u044c \u043d\u0430 \u043f\u043e\u0447\u0442\u0443″,»width»:600,»height»:450}},»isFavorited»:false}
4536 просмотров
Семейство интерферонов (IFN) — Creative Diagnostics
Обзор
Интерфероны (IFN) представляют собой группу сигнальных белков, производимых и высвобождаемых клетками-хозяевами в ответ на присутствие нескольких патогенов, таких как вирусы, бактерии, паразиты и опухолевые клетки. В типичном сценарии инфицированная вирусом клетка выделяет интерфероны, заставляя соседние клетки повышать свою противовирусную защиту.
IFN относятся к большому классу белков, известных как цитокины / молекулы, которые используются для связи между клетками, чтобы запустить защитные механизмы иммунной системы, которые помогают уничтожить патогены.Интерфероны названы из-за их способности «мешать» репликации вирусов, защищая клетки от вирусных инфекций. IFN также имеют различные другие функции: они активируют иммунные клетки, такие как естественные клетки-киллеры и макрофаги; они повышают защиту хозяина за счет активации презентации антигена за счет увеличения экспрессии антигенов главного комплекса гистосовместимости (MHC). Некоторые симптомы инфекций, такие как лихорадка, мышечная боль и «симптомы гриппа», также вызваны выработкой IFNs и других цитокинов.
Члены IFN
У животных, включая человека, идентифицировано более двадцати различных генов и белков IFN. Обычно их делят на три класса: IFN типа I, IFN типа II и IFN типа III. IFN, принадлежащие ко всем трем классам, важны для борьбы с вирусными инфекциями и для регуляции иммунной системы.
Таблица 1. Продукты, относящиеся к семейству IFN
Все IFN типа I связываются со специфическим рецепторным комплексом клеточной поверхности, известным как рецептор IFN-α / β (IFNAR), который состоит из цепей IFNAR1 и IFNAR2. Интерфероны типа I, присутствующие в организме человека, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Интерфероны типа I, присутствующие в организме человека, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Рисунок 1. Трехмерная структура человеческого интерферона бета.
| IFN-α | Белки IFN-α продуцируются лейкоцитами. Они в основном участвуют в врожденном иммунном ответе против вирусной инфекции. Гены, ответственные за их синтез, делятся на 13 подтипов, которые называются IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21.Эти гены находятся вместе в кластере на хромосоме 9. IFN-α также производится синтетически в качестве лекарства от лейкемии волосатых клеток. Международное непатентованное название (МНН) продукта — интерферон альфа. Рекомбинантный тип — интерферон альфакон-1. Пегилированные типы представляют собой пегилированный интерферон альфа-2a и пегилированный интерферон альфа-2b. |
| IFN-β | Белки IFN-β в больших количествах продуцируются фибробластами.Они обладают противовирусной активностью, которая участвует в основном в врожденном иммунном ответе. Были описаны два типа IFN-β: IFN-β1 (IFNB1) и IFN-β3 (IFNB3) (ген, обозначенный IFN-β2, на самом деле является IL-6). IFN-β1 используется для лечения рассеянного склероза, поскольку он снижает частоту рецидивов. IFN-β1 не подходит для лечения пациентов с прогрессирующими, не рецидивирующими формами рассеянного склероза. |
| IFN-κ | Интерферон каппа, также известный как IFN-каппа, представляет собой белок, который у человека кодируется геном IFNK.IFN-каппа является членом семейства интерферонов типа I. Интерфероны типа I представляют собой группу родственных гликопротеинов, которые играют важную роль в защите хозяина от вирусных инфекций. Этот белок экспрессируется в кератиноцитах, и ген находится на хромосоме 9, рядом с кластером интерферона типа I. |
| IFN-ω | IFN-ω, хотя и имеет только одну описанную на сегодняшний день функциональную форму (IFNW1), имеет несколько псевдогенов: IFNWP2, IFNWP4, IFNWP5, IFNWP9, IFNWP15, IFNWP18 и IFNWP19 у человека. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. |
Единственный член составляет интерфероны типа II (IFN), которые называются IFN-γ (гамма). Зрелый IFN-γ представляет собой антипараллельный гомодимер, который связывается с комплексом рецептора IFN-γ (IFNGR), чтобы вызвать сигнал в своей клетке-мишени. IFNGR состоит из двух субъединиц, и каждая из молекул обозначает IFNGR1 и IFNGR2.
IFN-γ участвует в регуляции иммунных и воспалительных реакций; у человека есть только один тип гамма-интерферона.Он вырабатывается активированными Т-клетками и естественными клетками-киллерами. IFN-γ обладает некоторыми противовирусными и противоопухолевыми эффектами, но, как правило, слабыми. Однако этот цитокин усиливает действие IFN типа I. IFN-γ, выделяемый клетками Th2, привлекает лейкоциты к месту инфекции, что приводит к усилению воспаления. Он также стимулирует макрофаги убивать бактерии, которые были поглощены. IFN-γ, выделяемый клетками Th2, также важен для регуляции ответа Th3. Поскольку IFN-γ жизненно важен для регуляции иммунного ответа, его продукция может приводить к аутоиммунным нарушениям.
Рисунок 2. Трехмерная структура гамма-интерферона человека.
Группа интерферонов III типа, классифицированная недавно, состоит из трех молекул IFN-λ (лямбда), называемых IFN-λ1, IFN-λ2 и IFN-λ3 (также называемых IL29, IL28A и IL28B соответственно). Эти сигналы IFN через рецепторный комплекс состоят из IL10R2 (также называемого CRF2-4) и IL28RA (также называемого IFNLR1, CRF2-12). Недавно новый белок со сходной функцией, связанный с IFN-λ3, был обнаружен в том же геномном локусе и был обозначен как IFN-λ4.Его внутриклеточная передача сигналов осуществляется через IFNLR1 и, следовательно, считается интерфероном типа III. Однако доказательства его биологической активности in vivo все еще остаются спорными.
IL29 | Интерлейкин-29 (IL-29) представляет собой белок, который у человека кодируется геном IL29, который находится на хромосоме 19.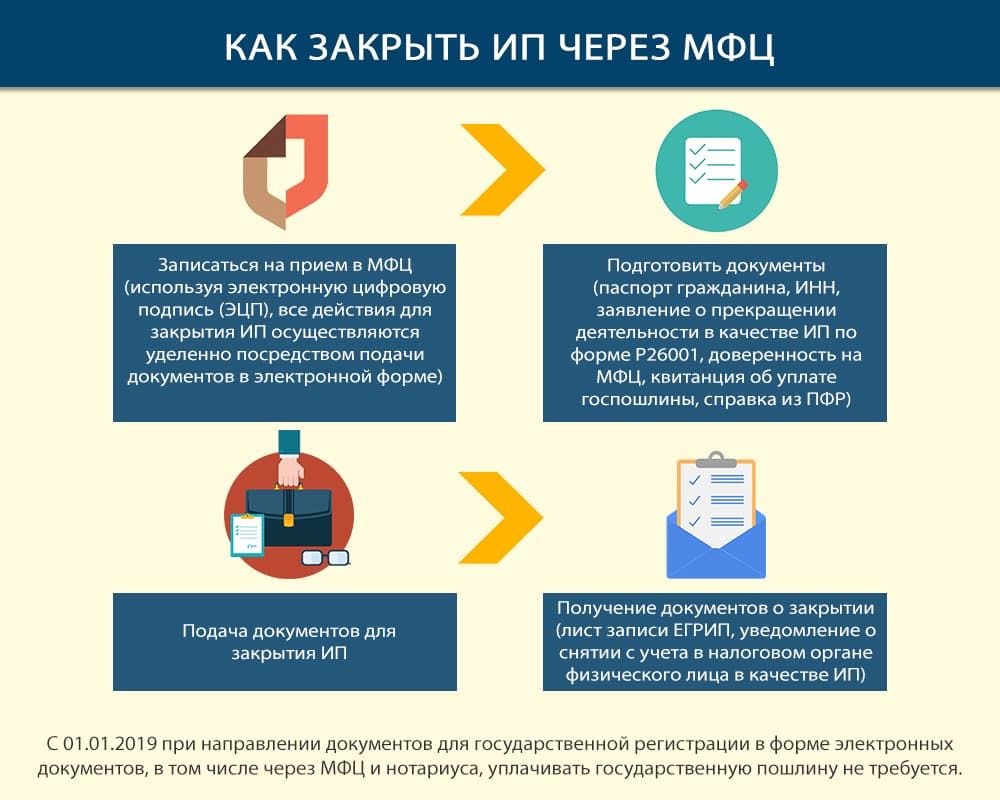 Он является членом семейства спиральных цитокинов и представляет собой интерферон III типа.Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген в высокой степени регулируется в клетках, инфицированных вирусами. IL29 не присутствует в геноме мыши. Он является членом семейства спиральных цитокинов и представляет собой интерферон III типа.Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген в высокой степени регулируется в клетках, инфицированных вирусами. IL29 не присутствует в геноме мыши. |
| IL28 | Интерлейкин-28 (IL-28) представляет собой цитокин, который представлен в двух изоформах, IL-28A и IL-28B, и играет роль в иммунной защите от вирусов, включая индукцию «антивирусного состояния» путем включения белков Mx, 2 ‘, 5’-олигоаденилатсинтетаза, а также ISGF3G (фактор 3 генов, стимулированный интерфероном).IL-28A и IL-28B относятся к семейству цитокинов интерферона III типа и очень похожи (по аминокислотной последовательности) на IL-29. Их классификация как интерферонов обусловлена их способностью вызывать противовирусное состояние, в то время как их дополнительная классификация как цитокинов обусловлена их хромосомным положением, а также тем фактом, что они кодируются несколькими экзонами, а не одним экзоном, как большинство типов. -I IFNs есть. |
Функции сотовой связи
Все интерфероны обладают несколькими общими эффектами: они являются противовирусными агентами и модулируют функции иммунной системы.Экспериментально показано, что введение IFN типа I ингибирует рост опухоли у животных, но положительное действие в отношении опухолей человека широко не документировано. Клетка, инфицированная вирусом, выделяет вирусные частицы, которые могут заразить соседние клетки. Однако инфицированная клетка может подготовить соседние клетки к потенциальной инфекции вирусом, высвобождая интерфероны. В ответ на интерферон клетки продуцируют большое количество фермента, известного как протеинкиназа R (PKR). Этот фермент фосфорилирует белок, известный как eIF-2, в ответ на новые вирусные инфекции; фосфорилированный eIF-2 образует неактивный комплекс с другим белком, называемым eIF2B, для снижения синтеза белка в клетке.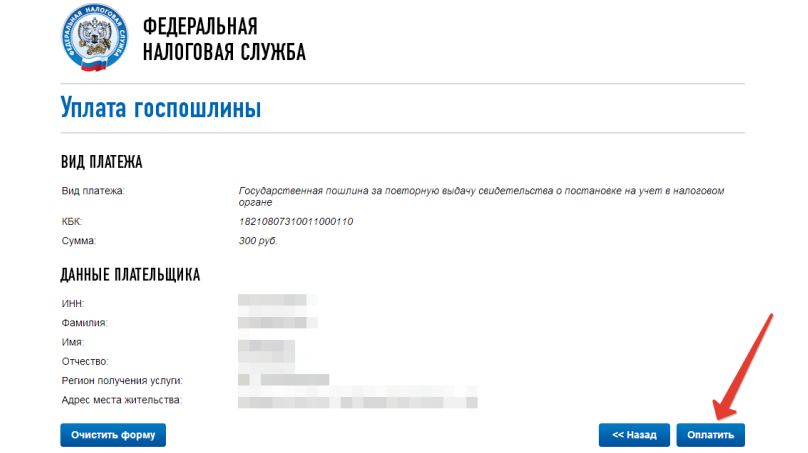 Другой клеточный фермент, РНКаза L, также индуцируемый действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов хозяина. Подавленный синтез белка разрушает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием гены, стимулированные интерфероном (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет увеличения активности р53, который убивает инфицированные вирусом клетки, способствуя апоптозу.Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой клеточный фермент, РНКаза L, также индуцируемый действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов хозяина. Подавленный синтез белка разрушает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием гены, стимулированные интерфероном (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет увеличения активности р53, который убивает инфицированные вирусом клетки, способствуя апоптозу.Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой функцией интерферонов является активация основных молекул комплекса гистосовместимости, MHC I и MHC II, и повышение активности иммунопротеасом. Более высокая экспрессия MHC I увеличивает представление вирусных пептидов цитотоксическим Т-клеткам, в то время как иммунопротеасома обрабатывает вирусные пептиды для загрузки на молекулу MHC I, тем самым увеличивая узнавание и уничтожение инфицированных клеток.Более высокая экспрессия MHC II увеличивает представление вирусных пептидов хелперным Т-клеткам; эти клетки выделяют цитокины (например, большее количество интерферонов и интерлейкинов), которые сигнализируют и координируют активность других иммунных клеток. Интерфероны, такие как гамма-интерферон, непосредственно активируют другие иммунные клетки, макрофаги и естественные клетки-киллеры.
Рис. 3. Линейное и мультипликационное изображение димера IFNγ.
Роль в болезни
Интерферон бета-1a и интерферон бета-1b используются для лечения и контроля рассеянного склероза, аутоиммунного заболевания.Это лечение эффективно для уменьшения приступов рецидивирующе-ремиттирующего рассеянного склероза и замедления прогрессирования заболевания и активности вторичного прогрессирующего рассеянного склероза.
Интерфероновая терапия используется (в сочетании с химиотерапией и лучевой терапией) для лечения некоторых видов рака. Это лечение можно использовать при гематологических злокачественных новообразованиях; лейкоз и лимфомы, включая лейкоз волосатых клеток, хронический миелоидный лейкоз, узловую лимфому и кожную Т-клеточную лимфому.Пациенты с рецидивирующими меланомами получают рекомбинантный IFN-α2b. И гепатит В, и гепатит С лечат IFN-α, часто в сочетании с другими противовирусными препаратами. Некоторые из тех, кто лечится интерфероном, обладают устойчивым вирусологическим ответом и могут элиминировать вирус гепатита. Наиболее опасный штамм — вирус гепатита С генотипа I — можно лечить с 60-80% успешностью лечения с помощью действующего стандарта лечения интерфероном-α, рибавирином и недавно одобренными ингибиторами протеазы, такими как телапревир (Инсивек), май 2011 г. , Боцепревир (Victrelis) май 2011 г. или ингибитор нуклеотидного аналога полимеразы Софосбувир (Sovaldi) декабрь 2013 г.Биопсия пациентов, получавших лечение, показывает уменьшение повреждений печени и цирроза. Некоторые данные показывают, что введение интерферона сразу после инфицирования может предотвратить хронический гепатит С, хотя диагностика на ранней стадии инфекции затруднена, поскольку физические симптомы на ранней стадии инфицирования гепатитом С редки. Контроль хронического гепатита С с помощью IFN связан с уменьшением гепатоцеллюлярной карциномы.
Имеются доказательства низкого качества, свидетельствующие о том, что глазные капли с интерфероном могут быть эффективным средством лечения людей с эпителиальным кератитом, вызванным вирусом простого герпеса, типом глазной инфекции.Нет четких доказательств того, что удаление инфицированной ткани (санация) с последующим нанесением капель интерферона является эффективным подходом к лечению этих типов глазных инфекций. Доказательства низкого качества предполагают, что комбинация интерферона и противовирусного агента может ускорить процесс заживления по сравнению с одной противовирусной терапией.
Артикул:
| 1. | Де Андреа М., Равера Р., Джоя Д., Гариглио М., Ландольфо С. (2002).«Интерфероновая система: обзор». Европейский журнал детской неврологии . 6 Suppl A (6): A41–6; обсуждение A55–8. |
| 2. | Леви Д.Е., Мари И. Дж., Дурбин Дж. Э. (декабрь 2011 г.). «Индукция и функция интерферона типа I и III в ответ на вирусную инфекцию». Текущее мнение в области вирусологии. 1 (6): 476–86. |
| 3. | Германт П., Михильс Т. (2014).«Интерферон-λ в контексте вирусных инфекций: продукция, ответ и терапевтические последствия». Журнал врожденного иммунитета . 6 (5): 563–74. |
| 4. | Navratil V, de Chassey B, Meyniel L, Pradezynski F, André P, Rabourdin-Combe C, Lotteau V (июль 2010 г.). «Сравнение на системном уровне белок-белковых взаимодействий между вирусами и сетью системы интерферона человека I типа». Журнал протеомных исследований. 9 (7): 3527–36. |
| 5. | Шарифф К.А., Дункан Д., Юноси З. (февраль 2002 г.). «Достижения в лечении хронического гепатита С:« пегилированные »интерфероны». Кливлендский медицинский журнал клиники. 69 (2): 155–9. |
| 6. | Тан Й.Х., Тишфилд Дж., Раддл Ф.Х. (февраль 1973 г.). «Связывание генов человеческого интерферон-индуцированного противовирусного белка и признаков индофенолоксидазы-B с хромосомой G-21». Журнал экспериментальной медицины. 137 (2): 317–30. |
Вернуться к ресурсам
Твиттер Facebook
Интерфероны I типа при инфекционных заболеваниях
Пестка С., Краузе К. Д. и Вальтер М. Р. Интерфероны, интерфероноподобные цитокины и их рецепторы. Immunol. Ред. 202 , 8–32 (2004).
Immunol. Ред. 202 , 8–32 (2004).
CAS PubMed Google Scholar
Шенборн, Дж.Р. и Уилсон, С. Б. Регулирование интерферона-γ во время врожденных и адаптивных иммунных ответов. Adv. Иммунол. 96 , 41–101 (2007).
CAS PubMed Google Scholar
О’Брайен, Т. Р., Прокунина-Олссон, Л. и Доннелли, Р. П. IFN-λ4: парадоксальный новый член семейства интерферонов λ. J. Interferon Cytokine Res. 34 , 829–838 (2014).
CAS PubMed PubMed Central Google Scholar
Прокунина-Ольссон, Л.и другие. Вариант перед IFNL3 ( IL28B ), создающий новый ген интерферона IFNL4 , связан с нарушением клиренса вируса гепатита С. Nature Genet. 45 , 164–171 (2013).
CAS PubMed Google Scholar
Витте, К., Витте, Э., Сабат, Р. и Волк, К. IL-28A, IL-28B и IL-29: многообещающие цитокины с интерфероноподобными свойствами I типа. Cytokine Growth Factor Rev. 21 , 237–251 (2010).
CAS PubMed Google Scholar
Дурбин, Р. К., Котенко, С. В., Дурбин, Дж. Э. Индукция и функция интерферона на поверхности слизистой оболочки. Immunol. Ред. 255 , 25–39 (2013).
PubMed PubMed Central Google Scholar
Ян Н. и Чен З. Дж. Внутренний противовирусный иммунитет. Nature Immunol. 13 , 214–222 (2012).
CAS Google Scholar
Goubau, D., Deddouche, S. & Reis e Sousa, C. Цитозольное зондирование вирусов. Иммунитет 38 , 855–869 (2013).
CAS PubMed Google Scholar
Палудан С. Р. и Боуи А. Г. Иммунное зондирование ДНК. Иммунитет 38 , 870–880 (2013).
Р. и Боуи А. Г. Иммунное зондирование ДНК. Иммунитет 38 , 870–880 (2013).
CAS PubMed PubMed Central Google Scholar
Leber, J.H. et al. Четкие TLR- и NLR-опосредованные транскрипционные ответы на внутриклеточный патоген. PLoS Pathog. 4 , e6 (2008).
PubMed PubMed Central Google Scholar
Pandey, A. K. et al. NOD2, RIP2 и IRF5 играют критическую роль в ответе интерферона типа I на Mycobacterium tuberculosis . PLoS Pathog. 5 , e1000500 (2009).
PubMed PubMed Central Google Scholar
Watanabe, T. et al. NOD1 участвует в защите мыши-хозяина от Helicobacter pylori посредством индукции IFN типа I и активации сигнального пути ISGF3. J. Clin. Вкладывать деньги. 120 , 1645–1662 (2010).
CAS PubMed PubMed Central Google Scholar
Морейра Л.О. и Замбони, Д. С. Передача сигналов NOD1 и NOD2 при инфекции и воспалении. Фронт. Иммунол. 3 , 328 (2012).
PubMed PubMed Central Google Scholar
Мойна, П. Н. Передача сигналов TLR и активация IRF: возвращение к старым друзьям из пути NF-κB. Trends Immunol. 26 , 469–476 (2005).
CAS PubMed Google Scholar
Хонда, К., Takaoka, A. & Taniguchi, T. Индукция гена интерферона типа I семейством факторов регуляции интерферона факторов транскрипции. Иммунитет 25 , 349–360 (2006).
CAS PubMed Google Scholar
Тамура Т., Янаи Х., Савицкий Д. и Танигучи Т. Факторы транскрипции семейства IRF в иммунитете и онкогенезе. Annu. Rev. Immunol. 26 , 535–584 (2008).
Annu. Rev. Immunol. 26 , 535–584 (2008).
CAS PubMed Google Scholar
Ивашков, Л.Б. и Донлин, Л. Т. Регулирование ответов интерферона типа I. Nature Rev. Immunol. 14 , 36–49 (2014). Этот обзор является прекрасной прелюдией к настоящему обзору и более подробно описывает молекулярные механизмы регуляции IFN типа I.
CAS Google Scholar
Раух И., Мюллер М. и Деккер Т. Регулирование воспаления интерферонами и их STAT. ДЖАКСТАТ 2 , e23820 (2013).
PubMed PubMed Central Google Scholar
Верстег, Г. А. и Гарсиа-Састре, А. Вирусные уловки для блокировки системы интерферона типа I. Curr. Opin. Microbiol. 13 , 508–516 (2010).
CAS PubMed PubMed Central Google Scholar
McNab, F. W., Rajsbaum, R., Stoye, J. P. & O’Garra, A. Трехчастные белки и регуляция врожденного иммунитета. Curr. Opin. Иммунол. 23 , 46–56 (2011).
CAS PubMed Google Scholar
Даймонд, М. С. и Шоггинс, Дж. У. Скрининг фактора ограничения хозяина: пусть вирус сделает свою работу. Клеточный микроб-хозяин 14 , 229–231 (2013).
CAS PubMed Google Scholar
Muller, U. et al. Функциональная роль интерферонов I и II типа в противовирусной защите. Наука 264 , 1918–1921 (1994).
CAS PubMed Google Scholar
Haller, O., Arnheiter, H., Gresser, I. & Lindenmann, J. Вирус-специфическое действие интерферона. Защита новорожденных носителей Mx от летального заражения вирусом гриппа. J. Exp. Med. 154 , 199–203 (1981).
J. Exp. Med. 154 , 199–203 (1981).
CAS PubMed Google Scholar
Дурбин, Дж.E. et al. IFN типа I модулирует врожденный и специфический противовирусный иммунитет. J. Immunol. 164 , 4220–4228 (2000).
CAS PubMed Google Scholar
Garcia-Sastre, A. et al. Роль интерферона в тканевом тропизме вируса гриппа. J. Virol. 72 , 8550–8558 (1998).
CAS PubMed PubMed Central Google Scholar
Кернер И., Кохс, Г., Калинке, У., Вайс, С. и Стахели, П. Защитная роль β-интерферона в защите хозяина от вируса гриппа А. J. Virol. 81 , 2025–2030 (2007).
CAS PubMed Google Scholar
Прайс, Г. Э., Гашевска-Мастарларц, А. и Москофидис, Д. Роль α / β и γ интерферонов в развитии иммунитета к вирусу гриппа А у мышей. J. Virol. 74 , 3996–4003 (2000).
CAS PubMed PubMed Central Google Scholar
Mordstein, M. et al. λ Интерферон делает эпителиальные клетки дыхательных путей и желудочно-кишечного тракта устойчивыми к вирусным инфекциям. J. Virol. 84 , 5670–5677 (2010).
CAS PubMed PubMed Central Google Scholar
Mordstein, M. et al. Интерферон-λ способствует врожденному иммунитету мышей против вируса гриппа А, но не против гепатотропных вирусов. PLoS Pathog. 4 , e1000151 (2008). Это исследование демонстрирует повторяющуюся роль IFN типа I и типа III в ответе против вируса гриппа, проясняя путаницу, возникшую из более ранней литературы, в которой сообщалось, что IFN типа I не могут учитывать потребность в передаче сигнала STAT1 для защиты от инфекции вируса гриппа.
PubMed PubMed Central Google Scholar
Crotta, S.и другие. Интерфероны типа I и типа III управляют избыточными петлями амплификации для индукции транскрипционной сигнатуры в инфицированном гриппом эпителии дыхательных путей. PLoS Pathog. 9 , e1003773 (2013). Это исследование демонстрирует повторяющуюся роль передачи сигналов IFN типа I и типа III в эпителиальных клетках в ответе против вируса гриппа, проясняя путаницу, возникшую в более ранней литературе по поводу защиты от инфекции вируса гриппа.
PubMed PubMed Central Google Scholar
Казанова, Дж.Л., Холланд, С. М. и Нотаранджело, Л. Д. Врожденные ошибки человеческих JAK и STAT. Иммунитет 36 , 515–528 (2012).
CAS PubMed PubMed Central Google Scholar
Zhang, S. Y. et al. Врожденные ошибки опосредованного интерфероном (IFN) иммунитета у людей: понимание соответствующих ролей IFN-α / β, IFN-γ и IFN-λ в защите хозяина. Immunol. Ред. 226 , 29–40 (2008).
CAS PubMed Google Scholar
Suppiah, V. et al. IL28B связан с ответом на терапию интерфероном-α хронического гепатита С и рибавирином. Nature Genet. 41 , 1100–1104 (2009).
CAS PubMed Google Scholar
Tanaka, Y. et al. Полногеномная ассоциация IL28B с ответом на терапию пегилированным интерфероном-α и рибавирином при хроническом гепатите С. Nature Genet. 41 , 1105–1109 (2009).
CAS PubMed Google Scholar
Ge, D. et al. Генетическая изменчивость IL28B предсказывает выведение вируса, вызванное лечением гепатита С.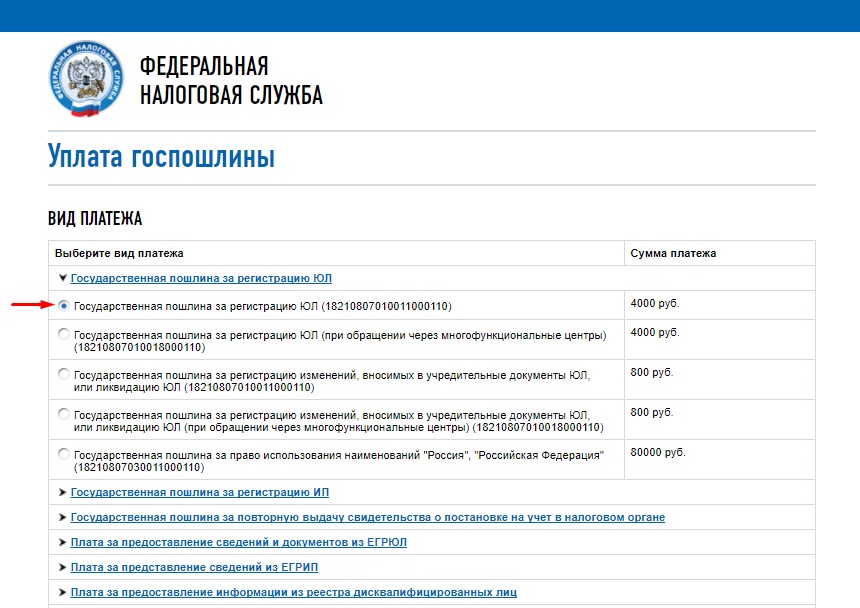 Природа 461 , 399–401 (2009).
Природа 461 , 399–401 (2009).
CAS PubMed Google Scholar
Thomas, D. L. et al. Генетическая изменчивость IL28B и спонтанная элиминация вируса гепатита С. Природа 461 , 798–801 (2009).
CAS PubMed PubMed Central Google Scholar
Sandler, N.G. et al. Реакция интерферона I типа у макак-резусов предотвращает инфекцию SIV и замедляет прогрессирование заболевания. Природа 511 , 601–605 (2014).
CAS PubMed PubMed Central Google Scholar
Эверит, А.R. et al. IFITM3 ограничивает заболеваемость и смертность от гриппа. Природа 484 , 519–523 (2012). Это исследование предоставило первые доказательства того, что генетика хозяина ( IFITM3 ) вносит вклад в предрасположенность человека к инфекции вируса гриппа.
CAS PubMed PubMed Central Google Scholar
Zhang, Y.H. et al. Интерферон-индуцированный генетический вариант трансмембранного белка-3 rs12252-C связан с тяжелым гриппом у китайцев. Nature Commun. 4 , 1418 (2013). Это исследование, продолжающееся по ссылке 38, показывающее, что IFITM3 вариантов, которые влияют на тяжесть инфекции вируса гриппа, преобладают в китайском населении.
Google Scholar
Staeheli, P., Grob, R., Meier, E., Sutcliffe, J. G. & Haller, O. Восприимчивые к вирусу гриппа мыши несут Mx генов с большой делецией или бессмысленной мутацией. Мол. Клетка. Биол. 8 , 4518–4523 (1988).
CAS PubMed PubMed Central Google Scholar
Хорисбергер, М.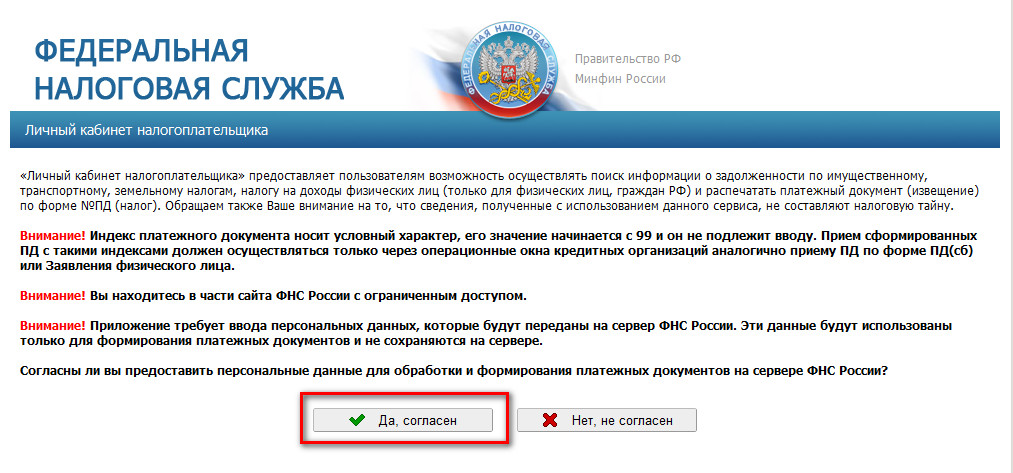 А., Стахели, П. и Халлер, О. Интерферон индуцирует уникальный белок в клетках мыши, несущих ген устойчивости к вирусу гриппа. Proc. Natl Acad. Sci. США 80 , 1910–1914 (1983).
А., Стахели, П. и Халлер, О. Интерферон индуцирует уникальный белок в клетках мыши, несущих ген устойчивости к вирусу гриппа. Proc. Natl Acad. Sci. США 80 , 1910–1914 (1983).
CAS PubMed Google Scholar
Хорби, П., Нгуен, Н. Ю., Данстан, С. Дж. И Бэйли, Дж. К. Роль генетики хозяина в восприимчивости к гриппу: систематический обзор. PLoS ONE 7 , e33180 (2012).
CAS PubMed PubMed Central Google Scholar
Dauer, M. et al. Интерферон-α выводит из строя предшественников дендритных клеток: дендритные клетки, полученные из обработанных интерфероном-α моноцитов, имеют дефекты созревания и стимуляции Т-клеток. Иммунология 110 , 38–47 (2003).
CAS PubMed PubMed Central Google Scholar
Lapenta, C. et al. Мощный иммунный ответ против ВИЧ-1 и защита от заражения вирусом у мышей hu-PBL-SCID, иммунизированных инактивированными дендритными клетками с импульсным воздействием вируса, созданными в присутствии IFN-α. J. Exp. Med. 198 , 361–367 (2003).
CAS PubMed PubMed Central Google Scholar
Сантини, С.M. et al. Интерферон типа I как мощный адъювант для развития и активности моноцитов дендритных клеток in vitro и у мышей Hu-PBL-SCID. J. Exp. Med. 191 , 1777–1788 (2000).
CAS PubMed PubMed Central Google Scholar
Santodonato, L. et al. Дендритные клетки, полученные из моноцитов, созданные после кратковременного культивирования с IFN-α и гранулоцитарно-макрофагальным колониестимулирующим фактором, стимулируют мощный Т-клеточный ответ CD8 + , специфичный для вируса Эпштейна-Барра. J. Immunol. 170 , 5195–5202 (2003).
CAS PubMed Google Scholar
Хам, Б., Трифило, М. Дж., Зунига, Э. И. и Олдстон, М. Б. Вирусы ускользают от иммунной системы посредством опосредованной интерфероном I типа STAT2-зависимой, но независимой от STAT1 передачи сигналов. Иммунитет 22 , 247–257 (2005).
CAS PubMed Google Scholar
Ито, Т.и другие. Дифференциальная регуляция субпопуляций дендритных клеток крови человека с помощью IFN. J. Immunol. 166 , 2961–2969 (2001).
CAS PubMed Google Scholar
Montoya, M. et al. Интерфероны типа I, продуцируемые дендритными клетками, способствуют их фенотипической и функциональной активации. Кровь 99 , 3263–3271 (2002).
CAS PubMed Google Scholar
Ле Бон, А.и другие. Перекрестный прайминг CD8 + Т-клеток, стимулированных вирус-индуцированным интерфероном I типа. Nature Immunol. 4 , 1009–1015 (2003).
CAS Google Scholar
Le Bon, A. et al. Прямая стимуляция Т-клеток IFN типа I усиливает Т-клеточный ответ CD8 + во время перекрестного прайминга. J. Immunol. 176 , 4682–4689 (2006).
CAS PubMed Google Scholar
Спадаро, Ф.и другие. IFN-α усиливает перекрестную презентацию в дендритных клетках человека, модулируя выживание антигена, маршрутизацию эндоцитов и процессинг. Кровь 119 , 1407–1417 (2012).
CAS PubMed Google Scholar
Parlato, S. et al. Экспрессия хемокинов CCR-7, MIP-3β и Th-1 в дендритных клетках, полученных из моноцитов, индуцированных IFN типа I: важность для быстрого приобретения мощной миграционной и функциональной активности. Кровь 98 , 3022–3029 (2001).
Кровь 98 , 3022–3029 (2001).
CAS PubMed Google Scholar
Rouzaut, A. et al. Дендритные клетки прикрепляются к лимфатическому эндотелию и мигрируют через него в ответ на IFN-α. Eur. J. Immunol. 40 , 3054–3063 (2010).
CAS PubMed Google Scholar
Gautier, G. et al. Аутокринно-паракринная петля интерферона типа I участвует в индуцированной Toll-подобным рецептором секреции дендритными клетками интерлейкина-12p70. J. Exp. Med. 201 , 1435–1446 (2005).
CAS PubMed PubMed Central Google Scholar
Cousens, L. P., Orange, J. S., Su, H. C. & Biron, C. A. Ингибирование интерфероном-α / β выработки интерлейкина 12 и интерферона-γ in vitro и эндогенно во время вирусной инфекции. Proc. Natl Acad. Sci. США 94 , 634–639 (1997).
CAS PubMed Google Scholar
Далод, М.и другие. Ответы интерферона α / β и интерлейкина 12 на вирусные инфекции: пути регуляции экспрессии цитокинов дендритных клеток in vivo . J. Exp. Med. 195 , 517–528 (2002).
CAS PubMed PubMed Central Google Scholar
Оранж, Дж. С., Вольф, С. Ф. и Бирон, С. А. Влияние IL-12 на реакцию и восприимчивость к экспериментальным вирусным инфекциям. J. Immunol. 152 , 1253–1264 (1994).
CAS PubMed Google Scholar
Orange, J. S. et al. Механизм опосредованной интерлейкином 12 токсичности при экспериментальных вирусных инфекциях: роль фактора некроза опухоли и глюкокортикоидов. J. Exp. Med. 181 , 901–914 (1995).
CAS PubMed Google Scholar
Le Bon, A. et al. Усиление ответа антител за счет прямой стимуляции В- и Т-клеток IFN типа I. J. Immunol. 176 , 2074–2078 (2006).
et al. Усиление ответа антител за счет прямой стимуляции В- и Т-клеток IFN типа I. J. Immunol. 176 , 2074–2078 (2006).
CAS PubMed Google Scholar
Havenar-Daughton, C., Kolumam, G. A. и Murali-Krishna, K. Прямое действие IFN типа I на CD4 T-клетки имеет решающее значение для поддержания клональной экспансии в ответ на вирусную, но не бактериальную инфекцию. J. Immunol. 176 , 3315–3319 (2006).
CAS PubMed Google Scholar
Бринкманн, В., Geiger, T., Alkan, S. & Heusser, C.H. Интерферон α увеличивает частоту продуцирования интерферона γ человеческими CD4 + Т-клетками. J. Exp. Med. 178 , 1655–1663 (1993).
CAS PubMed Google Scholar
Hofer, M. J. et al. У мышей с дефицитом STAT1, но не STAT2 или IRF9, после инфицирования вирусом лимфоцитарного хориоменингита развивается летальное заболевание, опосредованное Т-клетками CD4 + . J. Virol. 86 , 6932–6946 (2012).
CAS PubMed PubMed Central Google Scholar
Lazear, H. M., Pinto, A. K., Vogt, M. R., Gale, M. Jr & Diamond, M. S. β-Интерферон контролирует инфекцию вируса Западного Нила и патогенез у мышей. J. Virol. 85 , 7186–7194 (2011).
CAS PubMed PubMed Central Google Scholar
Шиоу, Л.R. et al. CD69 действует ниже интерферона-α / β, подавляя выход S1P1 и лимфоцитов из лимфоидных органов. Nature 440 , 540–544 (2006).
CAS PubMed Google Scholar
Petricoin, E. F. et al. Антипролиферативное действие интерферона-α требует компонентов передачи сигналов Т-клеточного рецептора. Nature 390 , 629–632 (1997).
Nature 390 , 629–632 (1997).
CAS PubMed Google Scholar
Казер, А., Nagata, S. & Tilg, H. Интерферон α увеличивает вызванную активацией смерть Т-клеток за счет усиления экспрессии Fas (CD95 / APO-1) и лиганда Fas. Цитокин 11 , 736–743 (1999).
CAS PubMed Google Scholar
Маршалл, Х. Д., Урбан, С. Л. и Уэлш, Р. М. Индуцированное вирусом временное подавление иммунитета и ингибирование пролиферации Т-клеток интерфероном типа I. J. Virol. 85 , 5929–5939 (2011).
CAS PubMed PubMed Central Google Scholar
Bromberg, J. F., Horvath, C. M., Wen, Z., Schreiber, R. D. и Darnell, J. E. Jr. Транскрипционно активный Stat1 необходим для антипролиферативного действия как интерферона α, так и интерферона γ. Proc. Natl. Акад. Sci. США 93 , 7673–7678 (1996).
CAS PubMed Google Scholar
Ли, К.K., Smith, E., Gimeno, R., Gertner, R. & Levy, D. E. STAT1 влияет на выживаемость и пролиферацию лимфоцитов, частично независимо от его роли после IFN-γ. J. Immunol. 164 , 1286–1292 (2000).
CAS PubMed Google Scholar
Tanabe, Y. et al. Роль STAT1, STAT3 и STAT5 в ответах IFN-α / β в Т-лимфоцитах. J. Immunol. 174 , 609–613 (2005).
CAS PubMed Google Scholar
Маррак, П., Kappler, J. & Mitchell, T. Интерфероны типа I поддерживают активность активированных Т-клеток. J. Exp. Med. 189 , 521–530 (1999).
CAS PubMed PubMed Central Google Scholar
Aichele, P. et al. CD8 T-клетки, специфичные для вируса лимфоцитарного хориоменингита, требуют рецептора IFN типа I для клональной экспансии. J. Immunol. 176 , 4525–4529 (2006).
CD8 T-клетки, специфичные для вируса лимфоцитарного хориоменингита, требуют рецептора IFN типа I для клональной экспансии. J. Immunol. 176 , 4525–4529 (2006).
CAS PubMed Google Scholar
Колумам, Г.А., Томас, С., Томпсон, Л. Дж., Спрент, Дж. И Мурали-Кришна, К. Интерфероны типа I действуют непосредственно на Т-клетки CD8, обеспечивая клональную экспансию и формирование памяти в ответ на вирусную инфекцию. J. Exp. Med. 202 , 637–650 (2005).
CAS PubMed PubMed Central Google Scholar
Curtsinger, J. M., Valenzuela, J. O., Agarwal, P., Lins, D. & Mescher, M. F. IFN типа I обеспечивают третий сигнал CD8 T-клеткам для стимуляции клональной экспансии и дифференцировки. J. Immunol. 174 , 4465–4469 (2005).
CAS PubMed Google Scholar
Keppler, SJ, Rosenits, K., Koegl, T., Vucikuja, S. & Aichele, P. Цитокины Signal 3 как модуляторы первичных иммунных ответов во время инфекций: взаимодействие IFN типа I и IL-12 в ответах Т-лимфоцитов CD8. PLoS ONE 7 , e40865 (2012).
CAS PubMed PubMed Central Google Scholar
Гимено, Р., Lee, C.K., Schindler, C. & Levy, D. E. Stat1 и Stat2, но не Stat3, регулируют противоречивые сигналы роста, вызванные интерфероном α / β в Т-лимфоцитах. Мол. Клетка. Биол. 25 , 5456–5465 (2005).
CAS PubMed PubMed Central Google Scholar
Гил, М. П., Саломон, Р., Лутен, Дж. И Бирон, С. А. Модуляция уровней белка STAT1: механизм формирования ответов Т-клеток CD8 in vivo . Кровь 107 , 987–993 (2006).
CAS PubMed PubMed Central Google Scholar
Agarwal, P. et al. Регуляция генов и ремоделирование хроматина с помощью IL-12 и IFN типа I в программировании эффекторной функции и памяти Т-лимфоцитов CD8. J. Immunol. 183 , 1695–1704 (2009).
et al. Регуляция генов и ремоделирование хроматина с помощью IL-12 и IFN типа I в программировании эффекторной функции и памяти Т-лимфоцитов CD8. J. Immunol. 183 , 1695–1704 (2009).
CAS PubMed PubMed Central Google Scholar
Маршалл, Х.Д., Принс, А. Л., Берг, Л. Дж. И Уэлш, Р. М. IFN-α / β и собственный MHC отклоняют Т-клетки CD8 на отдельный путь дифференцировки, характеризующийся быстрым приобретением эффекторных функций. J. Immunol. 185 , 1419–1428 (2010).
CAS PubMed PubMed Central Google Scholar
Cousens, L.P. et al. Разошлись два пути: опосредованные интерфероном α / β и интерлейкином 12 пути стимулирования Т-клеточного ответа на интерферон γ во время вирусной инфекции. J. Exp. Med. 189 , 1315–1328 (1999).
CAS PubMed PubMed Central Google Scholar
Nguyen, K. B. et al. Критическая роль активации STAT4 интерферонами 1 типа в ответе интерферона-γ на вирусную инфекцию. Наука 297 , 2063–2066 (2002).
CAS PubMed Google Scholar
Нгуен, К.B. et al. Опосредованное интерфероном α / β ингибирование и продвижение интерферона γ: STAT1 разрешает парадокс. Nature Immunol. 1 , 70–76 (2000).
CAS Google Scholar
Томпсон, Л. Дж., Колумам, Г. А., Томас, С. и Мурали-Кришна, К. Врожденные воспалительные сигналы, индуцируемые различными патогенами, по-разному определяют зависимость Т-лимфоцитов CD8 от IFN-I для клональной экспансии и формирования памяти. Дж.Иммунол. 177 , 1746–1754 (2006).
CAS PubMed Google Scholar
Pinto, A. K. et al. Временная роль передачи сигналов интерферона типа I в созревании CD8 + Т-клеток во время острой инфекции вируса Западного Нила. PLoS Pathog. 7 , e1002407 (2011).
K. et al. Временная роль передачи сигналов интерферона типа I в созревании CD8 + Т-клеток во время острой инфекции вируса Западного Нила. PLoS Pathog. 7 , e1002407 (2011).
CAS PubMed PubMed Central Google Scholar
Рамос, Х.J. et al. Взаимная чувствительность к интерлейкину-12 и интерферону-α определяет человеческий эффектор CD8 + по сравнению с судьбой Т-клеток центральной памяти. Кровь 113 , 5516–5525 (2009).
CAS PubMed PubMed Central Google Scholar
Кольмайер, Дж. Э., Кукенхэм, Т., Робертс, А. Д., Миллер, С. С. и Вудленд, Д. Л. Интерфероны типа I регулируют цитолитическую активность Т-клеток памяти CD8 + в дыхательных путях легких во время заражения респираторным вирусом. Иммунитет 33 , 96–105 (2010).
CAS PubMed PubMed Central Google Scholar
Sung, J.H. et al. Хемокиновый контроль центральных Т-клеток памяти имеет решающее значение для противовирусных реакций в лимфатических узлах. Ячейка 150 , 1249–1263 (2012).
CAS PubMed PubMed Central Google Scholar
Судья, С.M., Ruiz, A. L., Marie, J. C. & Lauvau, G. Воспалительные моноциты активируют CD8 + T памяти и врожденные лимфоциты NK независимо от родственного антигена во время инвазии микробных патогенов. Иммунитет 37 , 549–562 (2012).
CAS PubMed PubMed Central Google Scholar
Crouse, J. et al. Интерфероны типа I защищают Т-клетки от атаки NK-клеток, опосредованной активирующим рецептором NCR1. Иммунитет 40 , 961–973 (2014).
CAS PubMed Google Scholar
Xu, H. C. et al. Интерферон типа I защищает противовирусные CD8 + Т-клетки от цитотоксичности NK-клеток. Иммунитет 40 , 949–960 (2014).
C. et al. Интерферон типа I защищает противовирусные CD8 + Т-клетки от цитотоксичности NK-клеток. Иммунитет 40 , 949–960 (2014).
CAS PubMed Google Scholar
Hwang, I. et al. Механизмы активации естественных клеток-киллеров при заражении вирусом гриппа. PLoS ONE 7 , e51858 (2012).
CAS PubMed PubMed Central Google Scholar
Martinez, J., Huang, X. & Yang, Y. Прямое действие IFN типа I на NK-клетки необходимо для их активации в ответ на вирусную инфекцию коровьей оспы in vivo . J. Immunol. 180 , 1592–1597 (2008).
CAS PubMed Google Scholar
Нгуен, К.B. et al. Скоординированные и различные роли IFN-α / β, IL-12 и IL-15 в регуляции ответов NK-клеток на вирусную инфекцию. J. Immunol. 169 , 4279–4287 (2002).
CAS PubMed Google Scholar
Lucas, M., Schachterle, W., Oberle, K., Aichele, P. & Diefenbach, A. Дендритные клетки инициируют естественные клетки-киллеры с помощью транс- -представителя интерлейкина 15. Иммунитет 26 2007. Т. 503–517.
CAS PubMed PubMed Central Google Scholar
Сан, Дж. К., Ма, А. и Ланье, Л. Л. ИЛ-15-независимый ответ NK-клеток на инфекцию цитомегаловируса мышей. J. Immunol. 183 , 2911–2914 (2009).
CAS PubMed PubMed Central Google Scholar
Баранек Т. и др. Дифференциальные ответы иммунных клеток на интерферон типа I способствуют устойчивости хозяина к вирусной инфекции. Клеточный микроб-хозяин 12 , 571–584 (2012).
CAS PubMed Google Scholar
Miyagi, T. et al. Высокий базальный STAT4, сбалансированный индукцией STAT1, для контроля эффектов интерферона 1 типа в естественных клетках-киллерах. J. Exp. Med. 204 , 2383–2396 (2007).
et al. Высокий базальный STAT4, сбалансированный индукцией STAT1, для контроля эффектов интерферона 1 типа в естественных клетках-киллерах. J. Exp. Med. 204 , 2383–2396 (2007).
CAS PubMed PubMed Central Google Scholar
Mack, E.А., Каллал, Л. Е., Демерс, Д. А. и Бирон, С. А. Индукция интерфероном 1 типа продукции естественных клеток-киллеров γ-интерферона для защиты во время инфицирования вирусом лимфоцитарного хориоменингита. MBio 2 , e00169-11 (2011).
PubMed PubMed Central Google Scholar
Wang, J., Lin, Q., Langston, H. & Cooper, M. D. Резидентные макрофаги костного мозга продуцируют интерфероны 1 типа, которые могут избирательно ингибировать управляемый интерлейкином-7 рост клеток линии B. Иммунитет 3 , 475–484 (1995).
CAS PubMed Google Scholar
Лин, К., Донг, К. и Купер, М. Д. Нарушение развития Т- и В-клеток при лечении интерфероном типа I. J. Exp. Med. 187 , 79–87 (1998).
CAS PubMed PubMed Central Google Scholar
Босио, Э., Клунинг, К.L. & Beilharz, M. W. Низкие дозы интерферона I типа перорально снижают количество В-клеток селезенки у мышей. J. Interferon Cytokine Res. 21 , 721–728 (2001).
CAS PubMed Google Scholar
Le Bon, A. et al. Интерфероны типа I сильно усиливают гуморальный иммунитет и могут способствовать переключению изотипа путем стимуляции дендритных клеток in vivo . Иммунитет 14 , 461–470 (2001).
CAS PubMed Google Scholar
Swanson, C. L. et al. IFN типа I увеличивает вклад фолликулярных В-клеток в независимый от Т-клеток ответ антител. J. Exp. Med. 207 , 1485–1500 (2010).
J. Exp. Med. 207 , 1485–1500 (2010).
CAS PubMed PubMed Central Google Scholar
Coro, E. S., Chang, W. L. и Baumgarth, N. Сигналы рецепторов IFN типа I непосредственно стимулируют местные B-клетки на ранней стадии после инфицирования вирусом гриппа. J. Immunol. 176 , 4343–4351 (2006).
CAS PubMed Google Scholar
Chang, W. L. et al. Инфекция вируса гриппа вызывает модуляцию глобального ответа В-клеток дыхательных путей посредством сигналов врожденного иммунитета. J. Immunol. 178 , 1457–1467 (2007).
CAS PubMed Google Scholar
Рау, Ф.C., Dieter, J., Luo, Z., Priest, S.O. & Baumgarth, N. B7-1 / 2 (CD80 / CD86) прямой сигнал к В-клеткам усиливает секрецию IgG. J. Immunol. 183 , 7661–7671 (2009).
CAS PubMed PubMed Central Google Scholar
Heer, A. K. et al. Передача сигналов TLR точно настраивает ответы В-клеток против гриппа, не регулируя ответы эффекторных Т-клеток. J. Immunol. 178 , 2182–2191 (2007).
CAS PubMed Google Scholar
Fink, K. et al. Ранние опосредованные интерфероном сигналы типа I на В-клетках специфически усиливают противовирусные гуморальные ответы. Eur. J. Immunol. 36 , 2094–2105 (2006).
CAS PubMed Google Scholar
Bach, P. et al. Гликопротеин вируса везикулярного стоматита, отображающий ретровирусоподобные частицы, индуцирует зависимое от рецептора IFN типа I переключение на нейтрализующие антитела IgG. J. Immunol. 178 , 5839–5847 (2007).
CAS PubMed Google Scholar
Purtha, W. E., Chachu, K. A., Virgin, H. W. & Diamond, M. S. Ранняя активация B-клеток после заражения вирусом Западного Нила требует передачи сигналов α / β-интерферона, но не антигенного рецептора. J. Virol. 82 , 10964–10974 (2008).
E., Chachu, K. A., Virgin, H. W. & Diamond, M. S. Ранняя активация B-клеток после заражения вирусом Западного Нила требует передачи сигналов α / β-интерферона, но не антигенного рецептора. J. Virol. 82 , 10964–10974 (2008).
CAS PubMed PubMed Central Google Scholar
Moseman, E.A. et al. Поддержание В-клетками макрофагов субкапсулярного синуса защищает от смертельной вирусной инфекции независимо от адаптивного иммунитета. Иммунитет 36 , 415–426 (2012).
CAS PubMed PubMed Central Google Scholar
Бирон, К. А. Интерфероны α и β как иммунные регуляторы — новый взгляд. Иммунитет 14 , 661–664 (2001).
CAS PubMed Google Scholar
Дэвидсон, С., Кротта, С., МакКейб, Т. М. и Вак, А. Патогенный потенциал интерферона αβ при острой гриппозной инфекции. Nature Commun. 5 , 3864 (2014). Эта основополагающая публикация показывает, что, в отличие от догмы, IFN типа I могут вызывать заболеваемость и смертность, в отличие от защиты, во время инфицирования вирусом гриппа.
CAS Google Scholar
Mandl, J. N. et al. Дивергентная передача сигналов TLR7 и TLR9 и продукция интерферона типа I различают патогенные и непатогенные вирусные инфекции СПИДа. Nature Med. 14 , 1077–1087 (2008).
CAS PubMed Google Scholar
Jacquelin, B. et al. Непатогенная SIV-инфекция африканских зеленых мартышек вызывает сильный, но быстро контролируемый ответ IFN типа I. J. Clin. Вкладывать деньги. 119 , 3544–3555 (2009).
CAS PubMed PubMed Central Google Scholar
Ротгер, М. и другие. Сравнительная транскриптомика экстремальных фенотипов ВИЧ-1-инфекции человека и SIV-инфекции у сажистых мангабей и макак-резус. J. Clin. Вкладывать деньги. 121 , 2391–2400 (2011).
и другие. Сравнительная транскриптомика экстремальных фенотипов ВИЧ-1-инфекции человека и SIV-инфекции у сажистых мангабей и макак-резус. J. Clin. Вкладывать деньги. 121 , 2391–2400 (2011).
CAS PubMed PubMed Central Google Scholar
McNally, J. M. et al. Истощение сторонних CD8 Т-клеток во время вирус-индуцированных Т-клеточных и интерфероновых ответов. J. Virol. 75 , 5965–5976 (2001).
CAS PubMed PubMed Central Google Scholar
Chi, B. et al. Интерфероны α и λ вместе опосредуют подавление CD4 Т-клеток, индуцированное респираторно-синцитиальным вирусом. J. Virol. 80 , 5032–5040 (2006).
CAS PubMed PubMed Central Google Scholar
Gil, M. P. et al. Регулирование эффектов IFN типа 1 в T-клетках CD8 во время вирусных инфекций: изменение экспрессии STAT4 и STAT1 для функции. Кровь 120 , 3718–3728 (2012).
CAS PubMed PubMed Central Google Scholar
Herbeuval, J. P. et al. Дифференциальная экспрессия IFN-α и TRAIL / DR5 в лимфоидной ткани прогрессирующих и непрогрессорных пациентов, инфицированных ВИЧ-1. Proc. Natl Acad. Sci. США 103 , 7000–7005 (2006).
CAS PubMed Google Scholar
Харди, А.W., Graham, D. R., Shearer, G. M. & Herbeuval, J. P. ВИЧ превращает плазматические дендритные клетки (pDC) в экспрессирующие TRAIL киллерные pDC и подавляет корецепторы ВИЧ с помощью интерферона-α, индуцированного Toll-подобным рецептором 7. Proc. Natl Acad. Sci. США 104 , 17453–17458 (2007).
CAS PubMed Google Scholar
Herbeuval, J. P. et al. CD4 + Гибель Т-клеток, индуцированная инфекционным и неинфекционным ВИЧ-1: роль интерферон-зависимого, TRAIL / DR5-опосредованного апоптоза. Кровь 106 , 3524–3531 (2005).
P. et al. CD4 + Гибель Т-клеток, индуцированная инфекционным и неинфекционным ВИЧ-1: роль интерферон-зависимого, TRAIL / DR5-опосредованного апоптоза. Кровь 106 , 3524–3531 (2005).
CAS PubMed PubMed Central Google Scholar
van Grevenynghe, J. et al. Потеря В-клеток памяти во время хронической ВИЧ-инфекции вызывается Foxo3a- и TRAIL-опосредованным апоптозом. J. Clin. Вкладывать деньги. 121 , 3877–3888 (2011).
CAS PubMed PubMed Central Google Scholar
Лидтке, К., Groger, N., Manns, M.P. и Trautwein, C. Интерферон-α усиливает TRAIL-опосредованный апоптоз путем активации транскрипции каспазы-8 в клетках гепатомы человека. J. Hepatol. 44 , 342–349 (2006).
CAS PubMed Google Scholar
Shigeno, M. et al. Интерферон-α сенсибилизирует клетки гепатомы человека к TRAIL-индуцированному апоптозу за счет активации DR5 и инактивации NF-κB. Онкоген 22 , 1653–1662 (2003).
CAS PubMed Google Scholar
Toomey, N. L. et al. Индукция TRAIL-опосредованной программы самоубийства интерфероном α при первичной выпотной лимфоме. Онкоген 20 , 7029–7040 (2001).
CAS PubMed Google Scholar
Teijaro, J. R. et al. Стойкая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука 340 , 207–211 (2013).
CAS PubMed PubMed Central Google Scholar
Wilson, E. B. et al. Блокада хронической передачи сигналов интерферона типа I для контроля стойкой инфекции LCMV. Наука 340 , 202–207 (2013). Ссылки 128 и 129 были первыми, кто показал, что IFN типа I вносят вклад в патогенез, вызывая супрессивные механизмы при хронической инфекции LCMV.
CAS PubMed PubMed Central Google Scholar
Herold, S. et al. Апоптоз эпителия легких при пневмонии, вызванной вирусом гриппа: роль лиганда, индуцирующего апоптоз, экспрессируемого макрофагами. J. Exp. Med. 205 , 3065–3077 (2008).
CAS PubMed PubMed Central Google Scholar
Хогнер, К.и другие. Экспрессируемый макрофагами IFN-β способствует апоптотическому повреждению альвеолярных эпителиальных клеток при тяжелой пневмонии, вызванной вирусом гриппа. PLoS Pathog. 9 , e1003188 (2013).
PubMed PubMed Central Google Scholar
Chaperot, L. et al. Агонисты вирусов или TLR индуцируют TRAIL-опосредованную цитотоксическую активность плазматических дендритных клеток. J. Immunol. 176 , 248–255 (2006).
CAS PubMed Google Scholar
Фудзикура, Д.и другие. Интерферон типа I имеет решающее значение для экспрессии FasL на клетках легких и определяет тяжесть гриппа. PLoS ONE 8 , e55321 (2013).
CAS PubMed PubMed Central Google Scholar
McNally, B., Ye, F., Willette, M. и Flano, E. Локальная блокада эпителиального PDL-1 в дыхательных путях усиливает функцию Т-клеток и вирусный клиренс во время инфицирования вирусом гриппа. J. Virol. 87 , 12916–12924 (2013).
CAS PubMed PubMed Central Google Scholar
Brincks, E. L. et al. Величина ответа Т-клеток на клинически значимую дозу вируса гриппа регулируется TRAIL. J. Immunol. 187 , 4581–4588 (2011).
CAS PubMed PubMed Central Google Scholar
MacMicking, J. D. Интерферон-индуцируемые эффекторные механизмы в клеточно-автономном иммунитете. Nature Rev. Immunol. 12 , 367–382 (2012).
D. Интерферон-индуцируемые эффекторные механизмы в клеточно-автономном иммунитете. Nature Rev. Immunol. 12 , 367–382 (2012).
CAS Google Scholar
Казар Дж., Гиллмор Дж. Д. и Гордон Ф. Б. Влияние интерферона и индукторов интерферона на инфекции, вызванные невирусными внутриклеточными микроорганизмами, Chlamydia trachomatis . Заражение. Иммун. 3 , 825–832 (1971).
CAS PubMed PubMed Central Google Scholar
де ла Маза, Л.М., Петерсон, Э. М., Гебель, Дж. М., Фенни, К. В. и Чарнеки, С. В. Ингибирование Chlamydia trachomatis , индуцированное интерфероном: диссоциация с противовирусным и антипролиферативным действием. Заражение. Иммун. 47 , 719–722 (1985).
CAS PubMed PubMed Central Google Scholar
Ishihara, T. et al. Ингибирование роста Chlamydia trachomatis человеческим интерфероном-α: механизмы и синергетический эффект с интерфероном-γ и фактором некроза опухоли-α. Biomed. Res. 26 , 179–185 (2005).
CAS PubMed Google Scholar
Rothfuchs, A.G. et al. IFN-α / β-зависимая секреция IFN-γ макрофагами, происходящими из костного мозга, контролирует внутриклеточную бактериальную инфекцию. J. Immunol. 167 , 6453–6461 (2001).
CAS PubMed Google Scholar
Rothfuchs, A.G. et al. STAT1 регулирует IFN-αβ- и IFN-γ-зависимый контроль инфекции Chlamydia pneumoniae негемопоэтическими клетками. J. Immunol. 176 , 6982–6990 (2006).
CAS PubMed Google Scholar
Qiu, H. et al. Интерфероны типа I повышают восприимчивость к легочной инфекции Chlamydia muridarum за счет усиления апоптоза местных макрофагов. J. Immunol. 181 , 2092–2102 (2008).
J. Immunol. 181 , 2092–2102 (2008).
CAS PubMed Google Scholar
Opitz, B. et al. Legionella pneumophila индуцирует IFNβ в эпителиальных клетках легких через IPS-1 и IRF3, которые также контролируют репликацию бактерий. J. Biol. Chem. 281 , 36173–36179 (2006).
CAS PubMed Google Scholar
Plumlee, C. R. et al. Интерфероны направляют эффективный врожденный ответ на инфекцию Legionella pneumophila . J. Biol. Chem. 284 , 30058–30066 (2009).
CAS PubMed PubMed Central Google Scholar
Скьявони, Г. и др. IFN типа I защищает разрешающие макрофаги от инфекции Legionella pneumophila посредством IFN-γ-независимого пути. J. Immunol. 173 , 1266–1275 (2004).
CAS PubMed Google Scholar
Золото, J.A. et al. Экзогенный γ- и α / β-интерферон спасает человеческие макрофаги от гибели клеток, вызванной Bacillus anthracis . Заражение. Иммун. 72 , 1291–1297 (2004).
CAS PubMed PubMed Central Google Scholar
Bukholm, G., Berdal, B.P., Haug, C. & Degre, M. Мышиный интерферон фибробластов модифицирует инфекцию Salmonella typhimurium у новорожденных мышей. Заражение. Иммун. 45 , 62–66 (1984).
CAS PubMed PubMed Central Google Scholar
Niesel, D. W., Hess, C. B., Cho, Y. J., Klimpel, K. D. & Klimpel, G. R. Природные и рекомбинантные интерфероны ингибируют инвазию эпителиальных клеток Shigella spp. Заражение. Иммун. 52 , 828–833 (1986).
CAS PubMed PubMed Central Google Scholar
Манкузо, Г. и другие. Передача сигналов IFN типа I имеет решающее значение для устойчивости хозяина к различным видам патогенных бактерий. J. Immunol. 178 , 3126–3133 (2007).
и другие. Передача сигналов IFN типа I имеет решающее значение для устойчивости хозяина к различным видам патогенных бактерий. J. Immunol. 178 , 3126–3133 (2007).
CAS PubMed Google Scholar
Parker, D. et al. Streptococcus pneumoniae ДНК инициирует передачу сигналов интерферона I типа в дыхательных путях. МБио 2 , e00016-11 (2011).
PubMed PubMed Central Google Scholar
Вейгент, Д.А., Хафф, Т. Л., Петерсон, Дж. У., Стэнтон, Г. Дж. И Барон, С. Роль интерферона в стрептококковой инфекции у мышей. Microb. Патог. 1 , 399–407 (1986).
CAS PubMed Google Scholar
Kelly-Scumpia, K. M. et al. Передача сигналов интерферона типа I в гемопоэтических клетках необходима для выживания при полимикробном сепсисе мышей за счет регуляции CXCL10. J. Exp. Med. 207 , 319–326 (2010).
CAS PubMed PubMed Central Google Scholar
Weighardt, H. et al. IFN типа I модулирует защиту хозяина и позднее гипервоспаление при септическом перитоните. J. Immunol. 177 , 5623–5630 (2006).
CAS PubMed Google Scholar
Freudenberg, M.A. et al. Мышиный IL-12-независимый путь индукции IFN-γ грамотрицательными бактериями основан на активации STAT4 посредством передачи сигналов IFN и IL-18 типа I. J. Immunol. 169 , 1665–1668 (2002).
CAS PubMed Google Scholar
Auerbuch, V., Brockstedt, D. G., Meyer-Morse, N., O’Riordan, M. & Portnoy, D. A. Мыши, лишенные рецептора интерферона типа I, устойчивы к Listeria monocytogenes . J. Exp. Med. 200 , 527–533 (2004).
CAS PubMed PubMed Central Google Scholar
Карреро, Дж.A., Calderon, B. & Unanue, E.R. Интерферон типа I сенсибилизирует лимфоциты к апоптозу и снижает устойчивость к инфекции Listeria . J. Exp. Med. 200 , 535–540 (2004).
CAS PubMed PubMed Central Google Scholar
О’Коннелл, Р. М. и др. Продукция интерферона типа I увеличивает восприимчивость к инфекции Listeria monocytogenes . J. Exp. Med. 200 , 437–445 (2004). Ссылки 155–157 были первыми публикациями, демонстрирующими неблагоприятное действие IFN типа I при внутриклеточной инфекции бактериями L. monocytogenes .
CAS PubMed PubMed Central Google Scholar
Карреро, Дж. А., Кальдерон, Б. и Унануэ, Е. Р. Лимфоциты вредны во время раннего врожденного иммунного ответа против Listeria monocytogenes . J. Exp. Med. 203 , 933–940 (2006).
CAS PubMed PubMed Central Google Scholar
Stockinger, S. et al. Продукция IFN типа I повышает чувствительность макрофагов к гибели клеток, вызванной Listeria monocytogenes . J. Immunol. 169 , 6522–6529 (2002).
CAS PubMed Google Scholar
Цваферинк, Х., Stockinger, S., Hazemi, P., Lemmens-Gruber, R. & Decker, T. IFN-β увеличивает индуцированную листериолизином O проницаемость мембран и гибель макрофагов. J. Immunol. 180 , 4116–4123 (2008).
CAS PubMed Google Scholar
Zwaferink, H., Stockinger, S., Reipert, S. & Decker, T. Стимуляция индуцибельной экспрессии синтазы оксида азота β-интерфероном увеличивает некротическую гибель макрофагов при инфицировании Listeria monocytogenes . Заражение. Иммун. 76 , 1649–1656 (2008).
Заражение. Иммун. 76 , 1649–1656 (2008).
CAS PubMed PubMed Central Google Scholar
Dresing, P., Borkens, S., Kocur, M., Kropp, S. & Scheu, S. Репортерная модель флуоресценции определяет «Tip-DC» как клеточный источник интерферона β при листериозе мышей. PLoS ONE 5 , e15567 (2010).
CAS PubMed PubMed Central Google Scholar
Стокингер, С.и другие. Характеристика клеток, продуцирующих интерферон, у мышей, инфицированных Listeria monocytogenes . PLoS Pathog. 5 , e1000355 (2009).
PubMed PubMed Central Google Scholar
Rayamajhi, M., Humann, J., Penheiter, K., Andreasen, K. & Lenz, L.L. Индукция IFN-α / β позволяет Listeria monocytogenes подавлять активацию макрофагов IFN-γ. Дж.Exp. Med. 207 , 327–337 (2010).
CAS PubMed PubMed Central Google Scholar
Kearney, S.J. et al. IFN типа I подавляют рецептор IFN-γ миелоидных клеток, индуцируя рекрутирование комплекса 3 / NGFI-A-связывающий белок 1 в ответ на ранний рост, который подавляет транскрипцию ifngr1 . J. Immunol. 191 , 3384–3392 (2013).
CAS PubMed PubMed Central Google Scholar
Manca, C.и другие. Гипервирулентный M. tuberculosis W / Beijing штаммы активируют IFN типа I и повышают экспрессию негативных регуляторов пути Jak-Stat. J. Interferon Cytokine Res. 25 , 694–701 (2005).
CAS PubMed Google Scholar
Ordway, D. et al. Гипервирулентный штамм HN878 Mycobacterium tuberculosis индуцирует мощный Th2-ответ с последующим быстрым подавлением. J. Immunol. 179 , 522–531 (2007).
J. Immunol. 179 , 522–531 (2007).
CAS PubMed Google Scholar
Stanley, S. A., Johndrow, J. E., Manzanillo, P. & Cox, J. S. Ответ IFN типа I на инфекцию Mycobacterium tuberculosis требует секреции, опосредованной ESX-1, и вносит свой вклад в патогенез. J. Immunol. 178 , 3143–3152 (2007).
CAS PubMed Google Scholar
Manca, C.и другие. Вирулентность клинического изолята Mycobacterium tuberculosis у мышей определяется по неспособности индуцировать иммунитет типа Th2 и связана с индукцией IFN-α / β. Proc. Natl Acad. Sci. США 98 , 5752–5757 (2001). Это исследование было первой демонстрацией IFN типа I, способствующих обострению туберкулеза на экспериментальных моделях мышей.
CAS PubMed Google Scholar
Купер, А.М., Перл, Дж. Э., Брукс, Дж. В., Элерс, С. и Орм, И. М. Экспрессия гена синтазы оксида азота 2 не является существенной для ранней борьбы с Mycobacterium tuberculosis в легких мыши. Заражение. Иммун. 68 , 6879–6882 (2000).
CAS PubMed PubMed Central Google Scholar
Berry, M. P. et al. Интерферон-индуцируемая нейтрофильная сигнатура транскрипции крови при туберкулезе человека. Природа 466 , 973–977 (2010). Это исследование предоставило первое доказательство того, что передача сигналов, опосредованная IFN I типа, связана с активным туберкулезом у людей.
CAS PubMed PubMed Central Google Scholar
Клифф, Дж. М. и др. Определенные фазы паттерна экспрессии генов в крови при лечении туберкулеза отражают модуляцию гуморального иммунного ответа. J. Infect.Дис.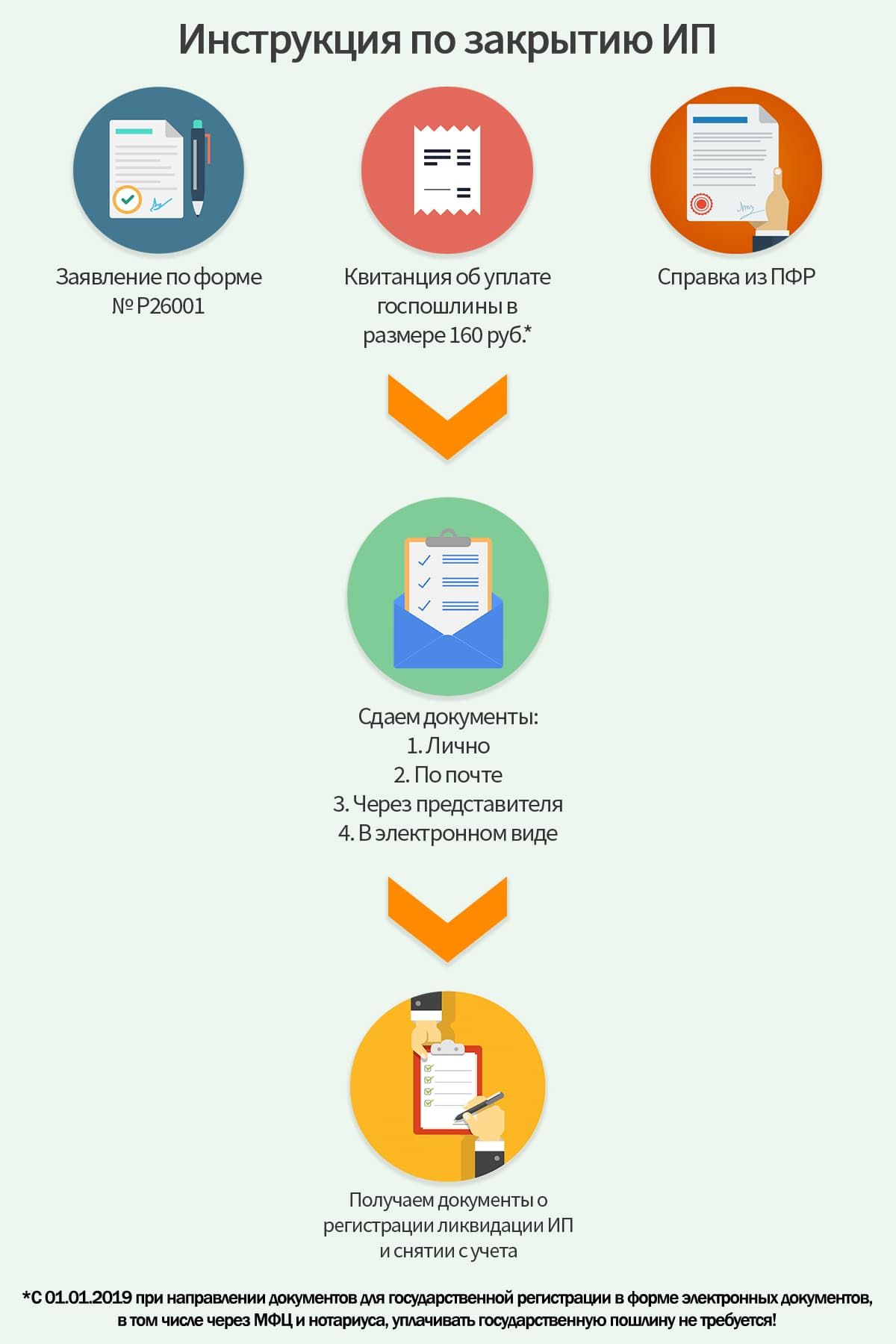 207 , 18–29 (2013).
207 , 18–29 (2013).
CAS PubMed Google Scholar
Maertzdorf, J. et al. Профили экспрессии генов человека восприимчивости и устойчивости к туберкулезу. Genes Immun. 12 , 15–22 (2011).
CAS PubMed Google Scholar
Ottenhoff, T.H. et al. Полногеномный профиль экспрессии позволяет идентифицировать пути ответа на интерферон 1 типа при активном туберкулезе. PLoS ONE 7 , e45839 (2012).
CAS PubMed PubMed Central Google Scholar
Антонелли, Л. Р. и др. Интраназальное введение поли-IC обостряет туберкулез у мышей из-за рекрутирования в легкие популяции моноцитов / макрофагов, допускающих патогены. J. Clin. Вкладывать деньги. 120 , 1674–1682 (2010).
CAS PubMed PubMed Central Google Scholar
Майер-Барбер, К.D. et al. Врожденные и адаптивные интерфероны подавляют продукцию IL-1α и IL-1β различными субпопуляциями легочного миелоида во время инфекции Mycobacterium tuberculosis . Иммунитет 35 , 1023–1034 (2011).
CAS PubMed PubMed Central Google Scholar
McNab, F. W. et al. Передача сигналов TPL-2-ERK1 / 2 способствует устойчивости хозяина к внутриклеточной бактериальной инфекции за счет отрицательной регуляции продукции IFN типа I. J. Immunol. 191 , 1732–1743 (2013).
CAS PubMed PubMed Central Google Scholar
Redford, P. S. et al. Вирус гриппа А нарушает контроль коинфекции Mycobacterium tuberculosis через рецептор-зависимый путь I типа. J. Infect. Дис. 209 , 270–274 (2014).
CAS PubMed Google Scholar
Майер-Барбер, К. D. et al. Независимая от каспазы-1 продукция IL-1β имеет решающее значение для устойчивости хозяина к Mycobacterium tuberculosis и не требует передачи сигналов TLR in vivo . J. Immunol. 184 , 3326–3330 (2010).
D. et al. Независимая от каспазы-1 продукция IL-1β имеет решающее значение для устойчивости хозяина к Mycobacterium tuberculosis и не требует передачи сигналов TLR in vivo . J. Immunol. 184 , 3326–3330 (2010).
CAS PubMed PubMed Central Google Scholar
de Paus, R.A. et al. Ингибирование иммунных ответов типа I моноцитов человека IFN-α и IFN-β. Цитокин 61 , 645–655 (2013).
CAS PubMed Google Scholar
Новиков А. и др. Mycobacterium tuberculosis запускает передачу сигналов IFN типа I хозяина для регулирования продукции IL-1β в макрофагах человека. J. Immunol. 187 , 2540–2547 (2011).
CAS PubMed PubMed Central Google Scholar
McNab, F. W. et al. IFN типа I индуцирует продукцию IL-10 независимым от IL-27 образом и блокирует ответную реакцию на IFN-γ для продукции IL-12 и уничтожения бактерий в макрофагах, инфицированных Mycobacterium tuberculosis . J. Immunol. 193 , 3600–3612 (2014). Это ключевое исследование демонстрирует механизмы, лежащие в основе неблагоприятных эффектов IFN типа I при туберкулезе, включая блокирование защитного действия IFN типа II, а также блокирование продукции IL-12, IL-1 и TNF, частично через IL-10. индукция.
CAS PubMed PubMed Central Google Scholar
Guarda, G. et al. Интерферон типа I подавляет выработку интерлейкина-1 и активацию инфламмасом. Иммунитет 34 , 213–223 (2011). Это было первое исследование, которое продемонстрировало ингибирование инфламмасомы IFN типа I.
CAS PubMed Google Scholar
Mayer-Barber, K. D. et al. Терапия туберкулеза, направленная на хозяина, основанная на взаимодействии интерлейкина-1 и интерферона I типа. Природа 511 , 99–103 (2014). Это плодотворное исследование показывает контррегулирующую функцию IL-1 и IFN типа I в контроле исходов M.tuberculosis через эйкозаноиды.
Природа 511 , 99–103 (2014). Это плодотворное исследование показывает контррегулирующую функцию IL-1 и IFN типа I в контроле исходов M.tuberculosis через эйкозаноиды.
CAS PubMed PubMed Central Google Scholar
Xu, X. J., Reichner, J. S., Mastrofrancesco, B., Henry, W. L. Jr & Albina, J. E. Простагландин E2 подавляет стимулируемое липополисахаридом производство IFN-β. J. Immunol. 180 , 2125–2131 (2008). Это исследование впервые продемонстрировало, что простагландин E2 подавляет стимулируемое липополисахаридом производство IFNβ.
CAS PubMed Google Scholar
Coulombe, F. et al. Нацеленное ингибирование простагландина E2 усиливает противовирусный иммунитет за счет индукции интерферона I типа и апоптоза в макрофагах. Иммунитет 40 , 554–568 (2014).
CAS PubMed Google Scholar
Телес, Р. М. и др. Интерферон I типа подавляет антимикобактериальные реакции человека, вызванные интерфероном II типа. Наука 339 , 1448–1453 (2013). В этом ключевом исследовании сообщается о механизме опосредованного IFN I типа блокирования защитной роли IFN II типа при туберкулезе.
CAS PubMed PubMed Central Google Scholar
Desvignes, L., Wolf, A. J. & Ernst, J. D. Динамическая роль IFN типа I и типа II в ранней инфекции Mycobacterium tuberculosis . Дж.Иммунол. 188 , 6205–6215 (2012). Это важное исследование показывает, что IFN типа I вносят вклад в защиту от M. tuberculosis , когда передача сигналов, опосредованная IFN типа II, является аберрантной.
CAS PubMed PubMed Central Google Scholar
Bogunovic, D. et al. Микобактериальные заболевания и нарушение иммунитета IFN-γ у людей с наследственным дефицитом ISG15. Наука 337 , 1684–1688 (2012).
et al. Микобактериальные заболевания и нарушение иммунитета IFN-γ у людей с наследственным дефицитом ISG15. Наука 337 , 1684–1688 (2012).
CAS PubMed PubMed Central Google Scholar
Mariotti, S. et al. Mycobacterium tuberculosis направляет индуцированную α-интерфероном дифференцировку моноцитов из дендритных клеток в иммунопривилегированные макрофагоподобные клетки-хозяева. Заражение. Иммун. 72 , 4385–4392 (2004).
CAS PubMed PubMed Central Google Scholar
Фернандес-Алнемри, Т.и другие. Инфламмасома AIM2 имеет решающее значение для врожденного иммунитета к Francisella tularensis . Nature Immunol. 11 , 385–393 (2010).
CAS Google Scholar
Henry, T., Brotcke, A., Weiss, D. S., Thompson, L.J. и Monack, D. M. Передача сигналов интерферона типа I необходима для активации воспаления во время инфекции Francisella . J. Exp. Med. 204 , 987–994 (2007).
CAS PubMed PubMed Central Google Scholar
Генри Т. и др. Передача сигналов IFN типа I ограничивает секрецию IL-17A / F γδ Т-клетками во время бактериальных инфекций. J. Immunol. 184 , 3755–3767 (2010).
CAS PubMed PubMed Central Google Scholar
Shah, S. et al. Mycobacterium tuberculosis , но не невирулентные микобактерии, ингибируют IFN-β и AIM2-зависимую от инфламмасом продукцию IL-1β через свою систему секреции ESX-1. J. Immunol. 191 , 3514–3518 (2013).
CAS PubMed PubMed Central Google Scholar
Al Moussawi, K. et al. Индукция интерферона типа I вредна при инфицировании бактерией болезни Уиппла, Tropheryma whipplei . PLoS Pathog. 6 , e1000722 (2010).
PLoS Pathog. 6 , e1000722 (2010).
PubMed PubMed Central Google Scholar
де Алмейда, Л.A. et al. Пути передачи сигналов MyD88 и STING необходимы для IRF3-опосредованной индукции IFN-β в ответ на инфекцию Brucella abortus . PLoS ONE 6 , e23135 (2011).
CAS PubMed PubMed Central Google Scholar
Патель, А.А., Ли-Льюис, Х., Хьюз-Хэнкс, Дж., Льюис, Калифорния, и Андерсон, Д.М. Противоположная роль регуляторного фактора 3 интерферона (IRF-3) и передачи сигналов интерферона I типа во время чумы . PLoS Pathog. 8 , e1002817 (2012).
CAS PubMed PubMed Central Google Scholar
Робинсон Н. и др. Интерферон I типа вызывает некроптоз в макрофагах при инфицировании сероваром Typhimurium Salmonella enterica . Nature Immunol. 13 , 954–962 (2012).
CAS Google Scholar
Ратинам, В.A. et al. TRIF лицензирует каспазо-11-зависимую активацию инфламмасом NLRP3 грамотрицательными бактериями. Ячейка 150 , 606–619 (2012).
CAS PubMed PubMed Central Google Scholar
Broz, P. et al. Каспаза-11 увеличивает восприимчивость к инфекции Salmonella в отсутствие каспазы-1. Природа 490 , 288–291 (2012).
CAS PubMed PubMed Central Google Scholar
Мартин, Ф.J. et al. Staphylococcus aureus активирует передачу сигналов IFN типа I у мышей и людей через повторяющиеся последовательности Xr белка A. J. Clin. Вкладывать деньги. 119 , 1931–1939 (2009).
CAS PubMed PubMed Central Google Scholar
Diefenbach, A. et al. Интерферон 1 типа (IFNα / β) и синтаза оксида азота 2 типа регулируют врожденный иммунный ответ на простейших паразитов. Иммунитет 8 , 77–87 (1998).
et al. Интерферон 1 типа (IFNα / β) и синтаза оксида азота 2 типа регулируют врожденный иммунный ответ на простейших паразитов. Иммунитет 8 , 77–87 (1998).
CAS PubMed Google Scholar
Mattner, J. et al. Регулирование синтазы оксида азота типа 2 интерферонами 1 типа в макрофагах, инфицированных Leishmania major . Eur. J. Immunol. 30 , 2257–2267 (2000).
CAS PubMed Google Scholar
Mattner, J. et al. Защита от прогрессирующего лейшманиоза с помощью IFN-β. J. Immunol. 172 , 7574–7582 (2004).
CAS PubMed Google Scholar
Khouri, R. et al. IFN-β снижает уничтожение супероксид-зависимых паразитов в макрофагах человека: доказательства пагубной роли SOD1 в кожном лейшманиозе. J. Immunol. 182 , 2525–2531 (2009).
CAS PubMed Google Scholar
Синь, Л.и другие. Рецептор IFN типа I регулирует функции нейтрофилов и врожденный иммунитет к паразитам Leishmania . J. Immunol. 184 , 7047–7056 (2010).
CAS PubMed PubMed Central Google Scholar
Haque, A. et al. Интерфероны типа I подавляют CD4 + Т-клеточно-зависимый контроль паразитов на стадии Plasmodium в крови. Eur. J. Immunol. 41 , 2688–2698 (2011).
CAS PubMed Google Scholar
Vigario, A. M. et al. Ингибирование малярии Plasmodium yoelii на стадии крови интерфероном α посредством ингибирования продукции его клетки-мишени, ретикулоцита. Кровь 97 , 3966–3971 (2001).
CAS PubMed Google Scholar
Vigario, A. M. et al. Рекомбинантный человеческий IFN-α подавляет церебральную малярию и снижает количество паразитов у мышей. J. Immunol. 178 , 6416–6425 (2007).
M. et al. Рекомбинантный человеческий IFN-α подавляет церебральную малярию и снижает количество паразитов у мышей. J. Immunol. 178 , 6416–6425 (2007).
CAS PubMed Google Scholar
Вузин, К., Мастелик, Б., Спонаас, А. М. и Лангхорн, Дж. Классические дендритные клетки CD11c + , а не плазмацитоидные дендритные клетки, индуцируют Т-клеточные ответы на малярию Plasmodium chabaudi . Внутр. J. Parasitol. 40 , 711–719 (2010).
CAS PubMed Google Scholar
Лил, П.и другие. Сенсоры клетки-хозяина для плазмодия активируют врожденный иммунитет против инфекции на стадии печени. Nature Med. 20 , 47–53 (2014).
CAS PubMed Google Scholar
Коста, В. М. и др. IFN типа I стимулируют выработку оксида азота и устойчивость к инфекции Trypanosoma cruzi . J. Immunol. 177 , 3193–3200 (2006).
CAS PubMed Google Scholar
Кога, Р.и другие. TLR-зависимая индукция IFN-β опосредует защиту хозяина против Trypanosoma cruzi . J. Immunol. 177 , 7059–7066 (2006).
CAS PubMed Google Scholar
Lopez, R., Demick, K. P., Mansfield, J. M. & Paulnock, D. M. IFN типа I играют роль в ранней устойчивости, но последующей восприимчивости к африканским трипаносомам. J. Immunol. 181 , 4908–4917 (2008).
CAS PubMed PubMed Central Google Scholar
Chessler, A. D., Caradonna, K. L., Da’dara, A. & Burleigh, B.A. Интерфероны типа I повышают восприимчивость хозяина к инфекции Trypanosoma cruzi . Заражение. Иммун. 79 , 2112–2119 (2011).
CAS PubMed PubMed Central Google Scholar
Уне, К., Andersson, J. & Orn, A. Роль IFN-α / β и IL-12 в активации естественных клеток-киллеров и продукции интерферона-γ во время экспериментального заражения Trypanosoma cruzi . Clin. Exp. Иммунол. 134 , 195–201 (2003).
CAS PubMed PubMed Central Google Scholar
Biondo, C. et al. Передача сигналов IFN-α / β необходима для поляризации цитокиновых ответов по отношению к защитному паттерну типа 1 во время экспериментального криптококкоза. J. Immunol. 181 , 566–573 (2008).
CAS PubMed Google Scholar
Biondo, C. et al. Распознавание дрожжевых нуклеиновых кислот запускает ответ на интерферон I типа, защищающий хозяина. Eur. J. Immunol. 41 , 1969–1979 (2011).
CAS PubMed Google Scholar
del Fresno, C. et al. Продукция интерферона-β посредством передачи сигналов Dectin-1-Syk-IRF5 в дендритных клетках имеет решающее значение для иммунитета к C.Альбиканс . Иммунитет 38 , 1176–1186 (2013).
CAS PubMed Google Scholar
Majer, O. et al. Интерфероны типа I способствуют фатальной иммунопатологии, регулируя воспалительные моноциты и нейтрофилы во время инфекций, вызываемых Candida . PLoS Pathog. 8 , e1002811 (2012).
CAS PubMed PubMed Central Google Scholar
Буржуаз, К.и другие. Обычные дендритные клетки вызывают IFN-ответ типа I против Candida spp. требующие новой фагосомной передачи сигналов IFN-β, опосредованной TLR7. J. Immunol. 186 , 3104–3112 (2011).
CAS PubMed Google Scholar
Инглис, Д. О., Беркес, К. А., Хокинг Мюррей, Д. Р. и Сил, А. Конидии, но не дрожжевые клетки грибкового патогена Histoplasma capsulatum запускают врожденный иммунный ответ интерферона I типа в мышиных макрофагах. Заражение. Иммун. 78 , 3871–3882 (2010).
CAS PubMed PubMed Central Google Scholar
Лю Л. и др. Мутации STAT1 человека с усилением функции нарушают иммунитет к IL-17 и лежат в основе хронического кожно-слизистого кандидоза. J. Exp. Med. 208 , 1635–1648 (2011).
CAS PubMed PubMed Central Google Scholar
van de Veerdonk, F.L. et al. STAT1 мутации при аутосомно-доминантном хроническом кожно-слизистом кандидозе. N. Engl. J. Med. 365 , 54–61 (2011).
CAS PubMed Google Scholar
Моренс, Д. М., Таубенбергер, Дж. К. и Фаучи, А. С. Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для готовности к пандемическому гриппу. J. Infect. Дис. 198 , 962–970 (2008).
PubMed PubMed Central Google Scholar
Li, W., Moltedo, B. & Moran, T. M. Индукция интерферона типа I во время инфицирования вирусом гриппа увеличивает восприимчивость к вторичной инфекции Streptococcus pneumoniae за счет отрицательной регуляции γδ Т-клеток. J. Virol. 86 , 12304–12312 (2012).
CAS PubMed PubMed Central Google Scholar
Накамура, С., Davis, K. M. & Weiser, J. N. Синергетическая стимуляция интерферонов типа I во время коинфекции вирусом гриппа способствует колонизации Streptococcus pneumoniae у мышей. J. Clin. Вкладывать деньги. 121 , 3657–3665 (2011).
J. Clin. Вкладывать деньги. 121 , 3657–3665 (2011).
CAS PubMed PubMed Central Google Scholar
Шахангян А. и др. IFN типа I опосредуют развитие бактериальной пневмонии после гриппа у мышей. Дж.Clin. Вкладывать деньги. 119 , 1910–1920 (2009).
CAS PubMed PubMed Central Google Scholar
Тиан, X. et al. Поли I: C повышает восприимчивость к вторичным легочным инфекциям, вызываемым грамположительными бактериями. PLoS ONE 7 , e41879 (2012).
CAS PubMed PubMed Central Google Scholar
Наварини, А.A. et al. Повышенная восприимчивость к бактериальной суперинфекции как следствие врожденных противовирусных реакций. Proc. Natl Acad. Sci. США 103 , 15535–15539 (2006).
CAS PubMed Google Scholar
Kim, Y.G. et al. Вирусная инфекция усиливает передачу сигналов Nod1 / 2, чтобы усилить летальность, связанную с вторичными бактериальными инфекциями. Клеточный микроб-хозяин 9 , 496–507 (2011).
CAS PubMed PubMed Central Google Scholar
Белкайд Ю. и Хэнд Т. В. Роль микробиоты в иммунитете и воспалении. Cell 157 , 121–141 (2014).
CAS PubMed PubMed Central Google Scholar
Ganal, S.C. et al. Праймирование естественных клеток-киллеров неслизистыми мононуклеарными фагоцитами требует инструктивных сигналов от комменсальной микробиоты. Иммунитет 37 , 171–186 (2012).
CAS PubMed Google Scholar
Abt, M.C. et al. Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета. Иммунитет 37 , 158–170 (2012).
Иммунитет 37 , 158–170 (2012).
CAS PubMed PubMed Central Google Scholar
Tschurtschenthaler, M. et al.Передача сигналов интерферона I типа в кишечном эпителии влияет на клетки Панета, микробную экологию и регенерацию эпителия. Кишечник 63 , 1921–1931 (2014).
CAS PubMed Google Scholar
Kawashima, T. et al. Двухцепочечная РНК кишечных комменсалов, но не патогенных бактерий, запускает выработку защитного интерферона-β. Иммунитет 38 , 1187–1197 (2013). Это исследование показывает, что микробиота способствует первоначальному производству защитных IFN типа I.Ссылки 235 и 236 в совокупности демонстрируют новое взаимодействие между микробиотой, IFN типа I и последующей защитой от патогенов.
CAS PubMed Google Scholar
Гоф Д. Дж., Мессина Н. Л., Кларк К. Дж., Джонстон Р. В. и Леви Д. Е. Конститутивный интерферон I типа модулирует гомеостатический баланс посредством тонической передачи сигналов. Иммунитет 36 , 166–174 (2012).
CAS PubMed PubMed Central Google Scholar
На страже границ: биология интерферонов типа III
При заражении вирусами млекопитающие (включая человека) реагируют, продуцируя интерфероны (IFN), которые вызывают антивирусное состояние в инфицированных и еще неинфицированных клетках, блокируя репликацию вирусов и распространение инфекции.Млекопитающие обладают тремя классами IFN: типом I (IFN-α / β), типом II (IFN-γ) и типом III (IFN-λs). Прямые противовирусные эффекты IFN типа II ограничены, но он оказывает плейотропное действие на разнообразный набор иммунных клеток, способствуя как адаптивным, так и врожденным ответам. IFN типа I и III вызывают сильное противовирусное состояние в чувствительных клетках, инициируя программу транскрипции, которая регулирует экспрессию нескольких сотен генов. В то время как почти все ядросодержащие клетки реагируют на IFN типа I, ответы на IFN типа III ограничиваются тканями с высоким риском вирусного воздействия и инфекции, такими как ткани слизистых оболочек.Это позволяет IFN типа III избирательно индуцировать сильное противовирусное состояние в тканях с высоким риском при ограниченных воспалительных издержках для организма-хозяина. Здесь мы рассмотрим роль IFN-λ как пограничного элемента организма и обсудим предполагаемую роль IFN-λ4. Этот парадоксальный белок обладает сильным противовирусным действием in vitro , но снижает клиренс вируса гепатита С (HCV) in vivo и может влиять на воспалительные процессы в печени.
В то время как почти все ядросодержащие клетки реагируют на IFN типа I, ответы на IFN типа III ограничиваются тканями с высоким риском вирусного воздействия и инфекции, такими как ткани слизистых оболочек.Это позволяет IFN типа III избирательно индуцировать сильное противовирусное состояние в тканях с высоким риском при ограниченных воспалительных издержках для организма-хозяина. Здесь мы рассмотрим роль IFN-λ как пограничного элемента организма и обсудим предполагаемую роль IFN-λ4. Этот парадоксальный белок обладает сильным противовирусным действием in vitro , но снижает клиренс вируса гепатита С (HCV) in vivo и может влиять на воспалительные процессы в печени.
Открытие и номенклатура
Семейство IFN типа III было обнаружено двумя группами 1,2 .Группы выбрали разные соглашения об именах, но впоследствии согласовали номенклатуру IFN-λ 3 . Здесь мы используем текущую номенклатуру и включаем в скобки уже оставленную номенклатуру. Мы перечисляем названия белков, но названия их кодирующих генов в целом эквивалентны, за исключением того, что греческие буквы заменены латинскими буквами (например, белок IFN-λ1 кодируется геном IFNL1 ). У человека семейство IFN типа III состоит из четырех членов: IFN-λ1 (IL-29), IFN-λ2 (IL28A), IFN-λ3 (IL-28B) и IFN-λ4 (см.4). У мышей есть два функциональных гена, кодирующих IFN-λ ( Ifnl2 и Ifnl3 ), и два псевдогена Ifnl1 Ifnl1 -P1 и Ifnl1 -P2 (рис. 1). Рецепторный комплекс IFN-λ состоит из специфической рецепторной цепи 1 IFN-λ (IFN-λR1 (IL28RA)) и общей рецепторной цепи 2 IL-10 (IL-10R2 (IL-10Rβ)).
Рисунок 1: Геномная организация IFN типа III у мышей и людей. Мышиные локусы Ifnl обнаружены на хромосоме 7 и содержат функциональные гены Ifnl2 и Ifnl3 , а также псевдогены Ifnl1 -P1 и Ifnl1 -P2.Дупликация локуса мыши произошла независимо от локуса человеческого IFNL , поэтому мышь Ifnl2 и Ifln3 не может считаться истинными ортологами человеческого IFNL2 и IFNL3 .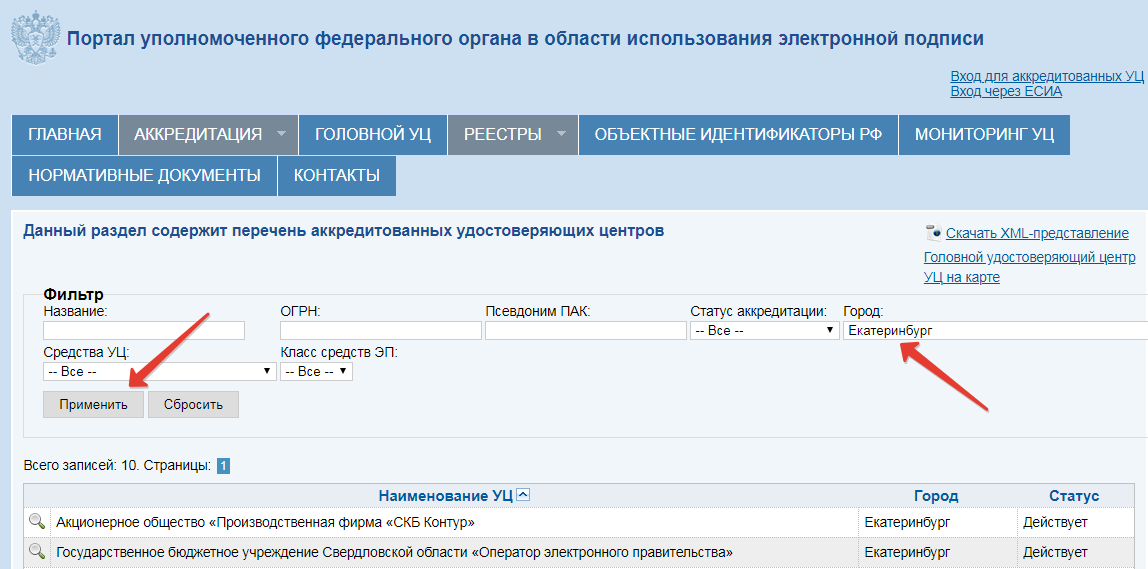 У человека локусы IFNL расположены на длинном плече хромосомы 19. У человека IFNL1 , IFNL2 и IFNL3 являются функциональными генами, а IFNL4 является псевдогеном в части популяции благодаря SNP. rs368234815.Кроме того, этот локус кодирует псевдогены INFL1P1 и IFNL4P1 . SNP, связанные со скоростью выведения вируса гепатита С, указываются либо их общепринятыми названиями, либо следствием вариации в скобках. Гены IFNL2 , IFNL3 , IFNL4 и IFNL4P1 , вероятно, были образованы в результате дупликации, в результате чего область, содержащая IFNL3 и IFNL4 , была дублирована, или образовалась IFNL2 909P и образовалась наоборот.Сайт рекомбинации расположен между IFNL4 и IFNL4P1 . Экзоны показаны зеленым цветом; стрелки указывают направление транскрипции. Псевдогены обозначены серыми прямоугольниками с символом Ψ и не масштабированы (за исключением IFNL4P1 ). Все человеческие псевдогены содержат интроны и, следовательно, не являются результатом ретротранспозиции.
У человека локусы IFNL расположены на длинном плече хромосомы 19. У человека IFNL1 , IFNL2 и IFNL3 являются функциональными генами, а IFNL4 является псевдогеном в части популяции благодаря SNP. rs368234815.Кроме того, этот локус кодирует псевдогены INFL1P1 и IFNL4P1 . SNP, связанные со скоростью выведения вируса гепатита С, указываются либо их общепринятыми названиями, либо следствием вариации в скобках. Гены IFNL2 , IFNL3 , IFNL4 и IFNL4P1 , вероятно, были образованы в результате дупликации, в результате чего область, содержащая IFNL3 и IFNL4 , была дублирована, или образовалась IFNL2 909P и образовалась наоборот.Сайт рекомбинации расположен между IFNL4 и IFNL4P1 . Экзоны показаны зеленым цветом; стрелки указывают направление транскрипции. Псевдогены обозначены серыми прямоугольниками с символом Ψ и не масштабированы (за исключением IFNL4P1 ). Все человеческие псевдогены содержат интроны и, следовательно, не являются результатом ретротранспозиции.
Включение рецептора IFN-λ и передача сигналов
Вовлечение рецепторного комплекса IFN-λ любым из четырех лигандов приводит к активации рецептор-ассоциированных тирозинкиназ JAK1 и TYK2, которые затем фосфорилируют специфические тирозины во внутриклеточном домене рецептор (рис.2). Это событие создает сайты стыковки для сигнальных молекул STAT1 и STAT2, что приводит к их рекрутированию и последующему фосфорилированию 1,2,5 . Фосфорилированные STAT привлекают регуляторный фактор 9 IFN (IRF9), которые вместе образуют фактор 3 гена, стимулированного IFN (ISGF3), который проникает в ядро и управляет транскрипцией генов, стимулированных IFN (ISG). Несмотря на использование разных рецепторов, IFN типа I и III активируют ISGF3 (ссылка 6) и, следовательно, вызывают очень похожие транскрипционные ответы 6,7,8,9 .IFNAR2 (часть рецепторного комплекса IFN типа I (рис. 2)) взаимодействует непосредственно с IFN-индуцированным белком Usp18, который ингибирует ответ на IFN-α 10 , но не на IFN-β или IFN-λ 11, 12 , тем самым создавая, по крайней мере, в клетках человека, петлю отрицательной обратной связи для IFN-α. В соответствии с этим IFN-β и IFN-λ вызывают пролонгированные ответы в культурах клеток, тогда как ответ на IFN-α короче по продолжительности 13,14 . Однако другое исследование показало ингибирующий эффект Usp18 на индукцию IFN-λ некоторых (но не всех) ISG, протестированных в мышиной системе 15 .
2)) взаимодействует непосредственно с IFN-индуцированным белком Usp18, который ингибирует ответ на IFN-α 10 , но не на IFN-β или IFN-λ 11, 12 , тем самым создавая, по крайней мере, в клетках человека, петлю отрицательной обратной связи для IFN-α. В соответствии с этим IFN-β и IFN-λ вызывают пролонгированные ответы в культурах клеток, тогда как ответ на IFN-α короче по продолжительности 13,14 . Однако другое исследование показало ингибирующий эффект Usp18 на индукцию IFN-λ некоторых (но не всех) ISG, протестированных в мышиной системе 15 .
IFN типа I передают сигнал через гетеродимерный рецептор, состоящий из высокоаффинной цепи IFNAR2 и низкоаффинной цепи IFNAR1. IFN типа III также передают сигнал через гетеродимерный рецептор, но он состоит из двух разных цепей: высокоаффинной цепи IFN-λR1 и низкоаффинной цепи IL-10R2 (которая является общей с другими цитокинами). Обе цепи с высоким сродством взаимодействуют с JAK1, тогда как две цепи с низким сродством взаимодействуют с TYK2.Передача сигналов ниже обоих рецепторов приводит к сборке фактора транскрипции ISGF3, который координирует экспрессию генов, содержащих элемент ответа на интерферон (ISRE).
Кристаллическая структура IFN-λ демонстрирует структуру пучка из четырех спиралей, типичную для цитокинов класса II, при этом ближайшим структурным гомологом IFN-λ является интерлейкин 22 (IL-22) 16 , но неясно, является ли это отражает общее эволюционное происхождение или конвергенцию, обусловленную тем фактом, что оба цитокина используют IL-10R2.Сайт связывания на цепи рецептора IFN-λR1 хорошо консервативен для всех четырех IFN-λ 16,17 , тогда как сайт связывания на IL-10R2 плохо определен.
Ткани, реагирующие на IFN типа III
У мышей ответ IFN типа III ограничен в основном эпителиальными тканями слизистых оболочек, при этом эпителий легких отвечает как на IFN типа I, так и на IFN III типа 18,19,20 , а эпителиальные клетки кишечника — исключительно к IFN типа III 21 . В печени мышей не наблюдается экспрессии IFNλR1 и реакции на IFN-λ in vivo 22,23 , но клеткам печени, полученным от мышей, необходим рецептор IFNλR1 для эффективного контроля репликации вируса 24 .У людей эпителиальные ткани слизистой оболочки, а также печень реагируют на IFN типа III 25,26 . Ответы на IFN типа III в иммунных клетках все еще исследуются и обсуждаются ниже. Дифференциальный сплайсинг гена IFNLR1 дает три мРНК. Вариант 1 приводит к экспрессии функционального рецептора; вариант 2 лишен части внутриклеточного домена и нефункционален; вариант 3 кодирует только внеклеточную часть рецептора 27 . Продукт варианта 3 высвобождается из клеток и может действовать как рецептор-ловушка и потенциально подавлять ответы IFN типа III 28 , но физиологическая роль вариантов сплайсинга 2 и 3 еще не установлена.Интересно, что эпигенетическое молчание, по-видимому, блокирует индукцию IFNLR1 в нечувствительных тканях 29 , но необходимы дополнительные исследования для понимания механизмов, регулирующих индукцию IFNLR1 , и физиологической роли его вариантов сплайсинга.
В печени мышей не наблюдается экспрессии IFNλR1 и реакции на IFN-λ in vivo 22,23 , но клеткам печени, полученным от мышей, необходим рецептор IFNλR1 для эффективного контроля репликации вируса 24 .У людей эпителиальные ткани слизистой оболочки, а также печень реагируют на IFN типа III 25,26 . Ответы на IFN типа III в иммунных клетках все еще исследуются и обсуждаются ниже. Дифференциальный сплайсинг гена IFNLR1 дает три мРНК. Вариант 1 приводит к экспрессии функционального рецептора; вариант 2 лишен части внутриклеточного домена и нефункционален; вариант 3 кодирует только внеклеточную часть рецептора 27 . Продукт варианта 3 высвобождается из клеток и может действовать как рецептор-ловушка и потенциально подавлять ответы IFN типа III 28 , но физиологическая роль вариантов сплайсинга 2 и 3 еще не установлена.Интересно, что эпигенетическое молчание, по-видимому, блокирует индукцию IFNLR1 в нечувствительных тканях 29 , но необходимы дополнительные исследования для понимания механизмов, регулирующих индукцию IFNLR1 , и физиологической роли его вариантов сплайсинга.
Экспрессия IFN типа III
Как и следовало ожидать от противовирусного цитокина, и во многом подобно IFN типа I 1 , IFN типа III могут индуцироваться широким спектром вирусов в разных типах клеток 30,31, 32 .IFN типа III может экспрессироваться во множестве первичных типов клеток человека гемопоэтической линии 33,34,35,36,37 , но эти типы клеток также в большом количестве продуцируют IFN типа I. Среди негематопоэтических клеток эпителиальные клетки являются мощными продуцентами IFN типа III 38,39,40 . На моделях мышей IFN типа III, по-видимому, являются основным типом IFN, обнаруживаемым в бронхоальвеолярном лаваже в ответ на инфекцию вирусом гриппа A 41 .
Индукция IFN опосредуется рецепторами распознавания образов, которые распознают вторгающийся вирус и инициируют транскрипционный ответ через факторы транскрипции NF-κB, IRF3 и IRF7 (см. 42). Ранние исследования генов, кодирующих IFN типа III, показали, что они имеют сайты связывания для факторов транскрипции NF-κB, IRF3, IRF7 и AP-1 в их промоторных областях 42,43,44 и, следовательно, могут коэкспрессироваться с типом I IFN. Кроме того, было высказано предположение, что индукция IFNL1 похожа на индукцию IFNB1 , поскольку, по-видимому, хорошо индуцируется как IRF3, так и IRF7, тогда как IFNL2 и IFNL3 , как и IFNA , в большей степени зависят от IRF7 и, по-видимому, имеют замедленную кинетику экспрессии.
42). Ранние исследования генов, кодирующих IFN типа III, показали, что они имеют сайты связывания для факторов транскрипции NF-κB, IRF3, IRF7 и AP-1 в их промоторных областях 42,43,44 и, следовательно, могут коэкспрессироваться с типом I IFN. Кроме того, было высказано предположение, что индукция IFNL1 похожа на индукцию IFNB1 , поскольку, по-видимому, хорошо индуцируется как IRF3, так и IRF7, тогда как IFNL2 и IFNL3 , как и IFNA , в большей степени зависят от IRF7 и, по-видимому, имеют замедленную кинетику экспрессии.
Позже стало ясно, что экспрессия IFN типа I и типа III не регулируется идентичными механизмами и может различаться для разных типов клеток и тестируемых стимулов. IFNL1 , в отличие от IFNB1 , обладает кластером дистальных сайтов NF-κB, которые необходимы для максимальной транскрипции IFNL1 и могут стимулировать индукцию гена IFNL1 независимым от IRF образом 45 . В эпителиальных клетках толстой кишки и дыхательных путей ZEB1 был идентифицирован как селективный репрессор транскрипции IFNL1 , что указывает на ключевое различие между регуляцией экспрессии IFN типов I и III 46,47 .Более того, индукция IFN типа III также может быть инициирована через сигнальный адаптер MAVS, когда он связан с пероксисомами 48 . Участие пероксисом в индукции IFNs типа III интересно, т.к. передача сигналов RIG-I-подобного рецептора через MAVS на пероксисомах не управляет индукцией IFNs типа I, но индуцирует экспрессию ISGs 49 . В гепатоцитах человека, инфицированных HCV или обработанных поли (I: C), индукция IFNL2 и IFNL3 зависела от IRF3 и IRF7, тогда как индукция IFNL1 также зависела от NF-κB 50 .Наконец, другая группа идентифицировала Med23, субъединицу медиаторного комплекса 51 , как партнера прямого взаимодействия для IRF7 (ссылка 52). Med23 и IRF7 синергетически увеличивают транскрипцию IFNL , но не влияют на IFNB1 .
IFN типа I и типа III и иммунный ответ слизистых оболочек
Роль IFN типа III была оценена при ряде вирусных инфекций либо путем добавления рекомбинантного IFN-λ, либо у мышей с дефицитом IFN-λR1.Избыточная и уникальная роль IFN типа I и типа III также была исследована. Неудивительно, что вирусный тропизм является основным определяющим фактором относительного вклада каждого типа IFN. Эпителиальные клетки кишечника отвечают исключительно на IFN типа III 21 , а система IFN типа III опосредует контроль над эпителиотропными вирусами, такими как ротавирусы, без избыточности 21 . Реовирусы инициируют инфекцию в эпителии кишечника, но могут проникать в эпителиальный слой и инфицировать клетки собственной пластинки или вызывать системную инфекцию у мышей.IFN типа III ограничивает начальную репликацию в эпителии кишечника и уменьшает выделение вируса через фекалии, но система IFN типа I необходима для предотвращения системной инфекции 53 . Таким образом, обе системы IFN необходимы для контроля реовирусной инфекции без избыточности. Точно так же при норовирусной инфекции IFN типа I ограничивает системное распространение вируса, но контроль вируса в желудочно-кишечном тракте достигается только в присутствии передачи сигналов IFN типа III 54 .Удивительно, но IFN типа III может элиминировать норовирус даже в отсутствие адаптивной иммунной системы. Защитному эффекту IFN типа III противодействуют кишечные комменсалы 55 , что объясняет, почему мыши дикого типа с функциональной системой IFN типа III все еще чувствительны к норовирусу. Стерилизация кишечника обработкой антибиотиками делает мышей более устойчивыми к норовирусу IFN-зависимым образом III типа 55 . Многие вирусы высвобождаются и распространяются с поверхности эпителия; Таким образом, можно ожидать, что IFN типа III играет роль в передаче вируса, и этот вопрос следует более тщательно изучить в будущем.Раннее исследование мышей с нокаутом IFN-λR1 выявило дефицит Toll-подобного рецептора 3 (TLR3) и TLR9-опосредованной противовирусной защиты во время вагинальной инфекции вирусом простого герпеса 2 (HSV-2), но не во время системной вирусной инфекции 56 . Таким образом, IFN типа III играют роль в эпителии влагалища, но в этой области требуются дальнейшие исследования. Сообщалось о непрямом эффекте интерферона типа III против вируса Западного Нила, при котором для целостности плотного соединения эндотелиальных клеток микрососудов головного мозга мышей и поддержания гематоэнцефалического барьера требовался IFN-λR1, что ограничивало нейроинвазию 57 .Этот эффект, по-видимому, происходит через неканонический сигнальный путь, который требует IFN-λR1, но не STAT1 или синтеза белка.
Таким образом, IFN типа III играют роль в эпителии влагалища, но в этой области требуются дальнейшие исследования. Сообщалось о непрямом эффекте интерферона типа III против вируса Западного Нила, при котором для целостности плотного соединения эндотелиальных клеток микрососудов головного мозга мышей и поддержания гематоэнцефалического барьера требовался IFN-λR1, что ограничивало нейроинвазию 57 .Этот эффект, по-видимому, происходит через неканонический сигнальный путь, который требует IFN-λR1, но не STAT1 или синтеза белка.
Компартментализация IFN типов I и III менее черно-белая в дыхательных путях, где существует определенная степень дублирования между двумя системами IFN 18,58 . Исследования на мышах с дефицитом IFN-λR1, IFNAR1 или обоих показали, что мыши, лишенные обоих (мыши с двойным дефицитом рецептора), были очень восприимчивы к респираторным инфекциям, тогда как мыши с одним дефицитом были в значительной степени устойчивы, как мыши дикого типа.Это указывает на более высокую степень избыточности двух систем IFN в дыхательных путях, чем в желудочно-кишечном тракте. Инфекция эпителиальных клеток дыхательных путей in vitro и последующие измерения IFN-индуцированной транскрипционной сигнатуры с помощью микроматрицы показали, что индуцированная гриппом сигнатура IFN отменяется только в рецепторном двойном дефицитном эпителии 9 , что подтверждает наблюдаемую избыточность in vivo . Таким образом, эпителий дыхательных путей экспрессирует рецепторы обоих типов IFN, тогда как некоторые или все эпителиальные клетки кишечника, по-видимому, экспрессируют только рецепторы IFN-λ.
Еще неизвестно, есть ли в дыхательных путях ниши, где клетки экспрессируют только IFN-λR1 и где IFN типа III играют уникальную роль, как в кишечнике. Можно предположить, что кишечник с его высоким риском неконтролируемого воспаления из-за огромного бремени связанных с микробами молекулярных паттернов, полученных из комменсалов, является компартментом, в котором желательно держать локальные реакции «ниже радара» системного иммунитета. Напротив, в легких, которые не являются стерильными, но определенно имеют бактериальную нагрузку на несколько порядков ниже, чем кишечник, разделение двух систем IFN менее строго.Во время инфицирования вирусом гриппа эпителий дыхательных путей мыши продуцирует большее количество IFN типа III, чем IFN типа I 9,41 . Следовательно, пока эпителиальные клетки легких являются основными продуцентами IFN, в ответе могут доминировать IFN типа III. Однако, как только иммунные клетки начинают продуцировать IFN, ответ может сместиться в сторону IFN типа I. Таким образом, разделение труда между ИФН типа III и типа I в легких может быть не таким строгим, как в кишечнике, но, по-видимому, следует аналогичной схеме.
Напротив, в легких, которые не являются стерильными, но определенно имеют бактериальную нагрузку на несколько порядков ниже, чем кишечник, разделение двух систем IFN менее строго.Во время инфицирования вирусом гриппа эпителий дыхательных путей мыши продуцирует большее количество IFN типа III, чем IFN типа I 9,41 . Следовательно, пока эпителиальные клетки легких являются основными продуцентами IFN, в ответе могут доминировать IFN типа III. Однако, как только иммунные клетки начинают продуцировать IFN, ответ может сместиться в сторону IFN типа I. Таким образом, разделение труда между ИФН типа III и типа I в легких может быть не таким строгим, как в кишечнике, но, по-видимому, следует аналогичной схеме.
Взятые вместе, наблюдения на мышиной модели рисуют четкую картину системы защиты IFN типа III, которая активна на границах, защищая слизистую оболочку от частого заражения вирусами. Это делает это при значительно более низком риске иммунной патологии, чем система IFN типа I, как обсуждается ниже. Мы считаем, что уроки, извлеченные из мышиной модели, в значительной степени верны для людей, где IFN типа III играет расширенную роль, обеспечивая защиту также от гепатотропных вирусов 26,59 .
Влияние IFN типа III на иммунные клетки
Хотя широко распространено мнение, что экспрессия IFN-λR1 более ограничена, чем экспрессия IFNAR1 и IFNAR2, все еще существуют некоторые разногласия относительно того, какие иммунные клетки продуцируют IFN типа III или реагируют на него и что функциональные последствия передачи сигналов IFN типа III в иммунных клетках. Появляется консенсус, показывающий, что плазмацитоидные дендритные клетки (pDC) человека и мыши, а также некоторые обычные подмножества DC (BDCA3 + у людей и CD8 + у мышей) продуцируют IFN типа III 35,60 .Точно так же только некоторые подмножества миелоидных иммунных клеток, такие как человеческие макрофаги, полученные из моноцитов 61 , pDC 60,61,62 и некоторые подмножества дендритных клеток у людей и мышей 63 , непосредственно отвечают на IFN типа III. В отношении естественных киллеров (NK) в отчетах были сделаны противоположные выводы о способности IFN типа III влиять на секрецию IFN-γ NK-клетками 64,65,66 . Однако эксперименты по адоптивному переносу на мышах с использованием IFN-λR1-дефицитных ( Ifnlr1 — / — ) NK-клеток пришли к выводу, что прямое воздействие типа III на NK-клетки необходимо для максимальной продукции IFN-γ и противоопухолевой активности 67 .Учитывая противоречивые выводы, по сути, есть три возможности. Во-первых, действие IFN типа III на NK-клетки выявляется только в сочетании с другими стимулами. Во-вторых, только определенные стадии созревания NK-клеток чувствительны к IFN типа III. В-третьих, наблюдаемые эффекты IFN типа III действительно косвенные.
В отношении естественных киллеров (NK) в отчетах были сделаны противоположные выводы о способности IFN типа III влиять на секрецию IFN-γ NK-клетками 64,65,66 . Однако эксперименты по адоптивному переносу на мышах с использованием IFN-λR1-дефицитных ( Ifnlr1 — / — ) NK-клеток пришли к выводу, что прямое воздействие типа III на NK-клетки необходимо для максимальной продукции IFN-γ и противоопухолевой активности 67 .Учитывая противоречивые выводы, по сути, есть три возможности. Во-первых, действие IFN типа III на NK-клетки выявляется только в сочетании с другими стимулами. Во-вторых, только определенные стадии созревания NK-клеток чувствительны к IFN типа III. В-третьих, наблюдаемые эффекты IFN типа III действительно косвенные.
Наконец, IFN типа III может подавлять ответы IL-1 и IL-17, а также рекрутирование нейтрофилов при артрите и других моделях воспаления 68 , что свидетельствует о прямом воздействии на нейтрофилы, которые экспрессируют IFN-λR1.Эти эффекты напоминают антагонизм между IFN типа I и IL-1, описанный в tuberculosis 69 . Сообщалось также о влиянии на Т-клетки и В-клетки 70,71 , но до сих пор неясно, являются ли эти эффекты прямыми или косвенными через вызванные IFN типа III изменения в антиген-презентирующих клетках, как описано выше. В нескольких сообщениях предполагается, что IFN типа III «способствует» индукции IL-12, что указывает на его роль в стимулировании иммунных ответов типа 1 по сравнению с типом 2 61,63,71 , и этот эффект может быть использован для лечения аллергии 63,72 и может быть полезным для индукции сильных противовирусных ответов от хелперных Т-клеток 1 типа (T H 1) и CD8 Т-клеток.
Из-за ограниченной экспрессии IFN-λR1 иммунными клетками иммуномодулирующие эффекты IFN типа III ограничены, что контрастирует с повсеместной активностью IFN типа I во время ответов на инфекцию 69 . Более широкий диапазон активности IFN типа I имеет решающее значение для борьбы с системной вирусной инфекцией, но риск увеличения тяжести заболевания всегда вырисовывается. Во многих отчетах описываются вредные эффекты несоответствующих ответов IFN типа I во время инфекции 73 , включая массивную индукцию провоспалительных цитокинов и продукцию индуцирующих апоптоз молекул на иммунных клетках во время острой инфекции 74 , а также при хроническом заболевании 75,76, 77,78,79 , где источником провоцирующего заболевание IFN типа I часто оказываются pDC.Кроме того, блокада адаптивных иммунных ответов за счет чрезмерной продукции IFN типа I во время хронической инфекции была подробно описана для Т-клеток 80,81 и, в меньшей степени, для В-клеток 71 .
Во многих отчетах описываются вредные эффекты несоответствующих ответов IFN типа I во время инфекции 73 , включая массивную индукцию провоспалительных цитокинов и продукцию индуцирующих апоптоз молекул на иммунных клетках во время острой инфекции 74 , а также при хроническом заболевании 75,76, 77,78,79 , где источником провоцирующего заболевание IFN типа I часто оказываются pDC.Кроме того, блокада адаптивных иммунных ответов за счет чрезмерной продукции IFN типа I во время хронической инфекции была подробно описана для Т-клеток 80,81 и, в меньшей степени, для В-клеток 71 .
Все эти открытия указывают в одном направлении: IFN типа III является противовирусным оружием выбора, когда локальный ответ слизистой оболочки достаточен для контроля вируса и когда иммуноопосредованное воспаление представляет собой реальный риск. Только при тяжелых или системных инфекциях было бы уместно « вытащить большие пушки » с системным ответом и сильной иммунной активацией, с соответствующим риском иммуно-опосредованного повреждения или паралича адаптивного иммунитета, что может поставить под угрозу или убить инфицированный организм. (Рисунок.3).
Рисунок 3: Эпителиальный и иммунный ответы на вирусную инфекцию в легких. ( a ) Когда респираторные вирусы заражают эпителий дыхательных путей, эти клетки могут устанавливать противовирусное состояние за счет аутокринного и паракринного действия IFN типа I или типа III. Оба типа продуцируются эпителием, который также экспрессирует рецептор IFN-λ. В случаях, когда в этом ответе преобладает IFN-λ, антивирусное состояние эпителия может быть установлено без системной активации иммунных клеток.( b ) Активация иммунных клеток, например, когда иммунные клетки сильно рекрутируются в инфицированное легкое или когда они подвергаются воздействию вируса, может вызвать иммунный ответ, управляемый IFN I типа. Поскольку IFN типа I обладает плейотропными иммуномодулирующими эффектами, активируются многие типы клеток с самыми разными последствиями. Здесь показаны только миелоидные иммунные клетки, но дополнительно активируются врожденные и адаптивные лимфоидные популяции. Соответствующие ответы, вызванные IFN I типа, активируют врожденные и адаптивные иммунные функции и приводят к элиминации вируса.Воспалительные процессы также обладают патогенным потенциалом и, следовательно, могут привести к иммуноопосредованному повреждению эпителия. iMC, воспалительный моноцит; AM, альвеолярный макрофаг.
Здесь показаны только миелоидные иммунные клетки, но дополнительно активируются врожденные и адаптивные лимфоидные популяции. Соответствующие ответы, вызванные IFN I типа, активируют врожденные и адаптивные иммунные функции и приводят к элиминации вируса.Воспалительные процессы также обладают патогенным потенциалом и, следовательно, могут привести к иммуноопосредованному повреждению эпителия. iMC, воспалительный моноцит; AM, альвеолярный макрофаг.
IFN типа III и коинфекция
IFN типа I может усиливать заболевание и ухудшать клиренс в случае инфекции такими бактериями, как Listeria monocytogenes и Mycobacterium tuberculosis , наиболее вероятно из-за подавления IFN типа I активации макрофагов IFN -γ 69,82,83 .У человека макрофаги, IFN-γ и активация TLR взаимодействуют друг с другом, активируя ряд важных антибактериальных молекул, и этому противодействует IFN типа I. Однако IFN типа III действует совершенно иначе, увеличивая чувствительность макрофагов к IFN-γ 61 . Конечный результат состоит в том, что IFN типа III «способствует» продукции цитокинов T H 1, таких как IL-12, как описано выше. Это интересно, поскольку большинство сравнений между индукцией гена, опосредованной IFN– I типа и IFN III типа, не показывают количественных различий или показывают лишь незначительные количественные различия.Однако в этой области требуются дальнейшие исследования.
Различие между эффектами интерферонов типа I и типа III может быть важным, особенно в контексте вирусно-бактериальной коинфекции, которая часто наблюдается, например, при инфекциях вирусом гриппа и может привести к тяжелому заболеванию 84,85 . Следовательно, IFN типа III защищает границы от вирусной инфекции, не вызывая широко распространенной иммунной активации, но он также может быть лучше, чем IFN типа I, в том, что касается предотвращения вмешательства в антибактериальные иммунные ответы, необходимые во время воздействия полимикробов. Кроме того, необходимо изучить, влияет ли IFN типа III на ответы T H 17, что особенно важно при коинфекциях с участием вирусов и внеклеточных бактерий.
Кроме того, необходимо изучить, влияет ли IFN типа III на ответы T H 17, что особенно важно при коинфекциях с участием вирусов и внеклеточных бактерий.
Почему IFN-λ4 ухудшает клиренс ВГС?
ВГС вызывает хроническую инфекцию примерно у 75% людей, тогда как остальным людям удается избавиться от инфекции в течение первого года 86 . Генетический фон хозяина важен как для спонтанного, так и для вызванного лечением клиренса вируса.В 2009 году несколько независимых консорциумов, используя довольно разные когорты, инфицированные ВГС, картировали основную генетическую детерминанту клиренса ВГС в ответ на лечение IFN-α плюс рибавирин с локусами IFN типа III 87,88,89,90 . Такая же ассоциация была обнаружена при спонтанном удалении вируса 90,91 . Тем не менее, два разных однонуклеотидных полиморфизма (SNP) были определены как лучший предиктор результата лечения: rs8099917 (далее сокращается до 917) лучше всего предсказывал исход у азиатов и людей европейского происхождения, тогда как rs12979860 (далее сокращенно до 860) был лучшим. предиктор в американской когорте смешанной этнической принадлежности (рис.1). Оба SNP были первоначально описаны как связанные с IL28B (т. Е. С IFNL3 ), и они неожиданно не находились в состоянии полного неравновесия по сцеплению (что означает, что они не наследуются вместе), как можно было бы ожидать, если бы они представляли одну и ту же лежащую в основе причинный генетический дефект. Что было более удивительно, так это то, что только один из идентифицированных SNP был локализован в кодирующих областях известных IFN типа III (изменение Lys70 в IFN-λ3 на аргинин, что не влияло на функцию IFN-λ3) 92 .Эти данные привели к предположению, что эти SNP представляют изменения в промоторной области IFNL3 и вызывают различия в экспрессии IFN-λ3. Однако последующие исследования пришли к разным выводам о влиянии SNP на экспрессию IFN-λ3, и этот вопрос до сих пор полностью не решен.
Прорыв произошел с открытием гена IFNL4 , расположенного в области, определяющей клиренс ВГС. Было обнаружено, что SNP rs368234815 превосходит SNP 860 в прогнозировании результатов лечения у лиц африканского происхождения.Аллель TT rs368234815 нарушает открытую рамку считывания IFNL4 и является защитным с точки зрения HCV, тогда как предковый аллель «ΔG» кодирует функциональный IFN-λ4 и ухудшает клиренс HCV. Это открытие предполагает, что IFN-λ4 является причиной неэффективности выведения HCV, но не объясняет, почему SNP 917 является мощным предиктором результата лечения в некоторых других популяциях. Обнаружение второго SNP, действующего в сочетании с SNP ΔG, разрешило это несоответствие. SNP rs117648444 (далее сокращается до 444) представляет собой несинонимичное изменение в кодирующей области IFNL4 , где остаток пролина заменяется серином, что приводит к двум версиям IFN-λ4: полностью активному IFN-λ4 – P70 и гораздо менее активный IFN-λ4 – S70 (ref.93). Комбинируя ΔG и 444 SNP, можно разделить пациентов на три группы: (i) пациенты без IFN-λ4, (ii) пациенты с IFN-λ4-P70 и (iii) пациенты с IFN-λ4-S70. По сравнению с одиночными SNP, описанными ранее, эта стратификация привела к значительному улучшению предсказательной силы генотипирования и отражает существование набора различных гаплотипов у людей (гаплотип — это набор тесно связанных аллелей, которые, вероятно, будут унаследованы вместе. ). До открытия гена IFNL4 элегантная работа идентифицировала вероятный причинный гаплотип путем массивного параллельного секвенирования 94 .У людей европейского происхождения этот гаплотип специфически помечен SNP 917 и кодирует вариант IFN-λ4 – P70, тогда как SNP 860 отмечает несколько гаплотипов, кодирующих варианты IFN-λ4 как P70, так и S70, но не мутацию сдвига рамки считывания. В обоих случаях группой пациентов, имеющей IFN-λ4-S70, в некоторой степени пренебрегают, и очевидное несоответствие может быть устранено путем генотипирования и стратификации, как описано выше. Примечательно, что до сих пор это было сделано только для одной европейской когорты, инфицированной ВГС, и будет важно повторить ее в разных когортах.В частности, влияние варианта IFN-λ4 – S70 может различаться в зависимости от заболеваний и этнического происхождения. Таким образом, более высокая скорость выведения HCV у пациентов, кодирующих вариант IFN-λ4-S70, чем у пациентов с IFN-λ4-P70, убедительно свидетельствует о том, что активность белка IFN-λ4 вызывает, пока неизвестным образом, плохой клиренс HCV.
Примечательно, что до сих пор это было сделано только для одной европейской когорты, инфицированной ВГС, и будет важно повторить ее в разных когортах.В частности, влияние варианта IFN-λ4 – S70 может различаться в зависимости от заболеваний и этнического происхождения. Таким образом, более высокая скорость выведения HCV у пациентов, кодирующих вариант IFN-λ4-S70, чем у пациентов с IFN-λ4-P70, убедительно свидетельствует о том, что активность белка IFN-λ4 вызывает, пока неизвестным образом, плохой клиренс HCV.
Действие генотипа IFNL4 не ограничивается терапиями на основе IFN для HCV; он также распространяется на противовирусные препараты прямого действия 95,96,97,98,99 .Кроме того, генотип IFNL4 также влияет на реактивацию цитомегаловируса (CMV) у пациентов с ослабленным иммунитетом 100,101 . Данные ясны, но парадоксальны. IFN-λ4 передает сигналы через тот же рецептор, что и другие члены семейства IFN типа III, и его действие очень похоже. Кроме того, IFN-λ4 является противовирусным in vitro 102 . Тем не менее, наличие функционального гена IFNL4 делает людей менее способными вылечить хронические инфекции, такие как HCV и CMV.Вероятно, что IFN-λ4 прямо или косвенно влияет на воспалительные реакции и, таким образом, на клиренс вируса. В нескольких исследованиях сообщалось об усилении воспаления и фиброза печени 103,104,105,106 и повышенной активности дегрануляции лимфоцитов 107 у пациентов с ВГС с защитным генотипом IFNL4 (аллель TT, который разрушает открытую рамку считывания IFNL4 ), что позволяет предположить, что IFN-λ4 снижает клиренс ВГС, но уменьшает воспаление и фиброз печени.Другие исследования не обнаружили никакой связи или имели прямо противоречивые данные, но использовали меньшие когорты. Интересно, что исследование показало, что уменьшение воспаления и фиброза печени было связано с наличием функционального гена IFNL4 в когорте неалкогольной жировой болезни печени, что указывает на то, что влияние IFN-λ4 на воспаление может быть независимым от вирусной инфекции 104 . Однако этот вывод нуждается в подтверждении другими исследованиями. В настоящее время мы не можем предложить механистического объяснения.
Однако этот вывод нуждается в подтверждении другими исследованиями. В настоящее время мы не можем предложить механистического объяснения.
Ген
IFNL4 стал уязвимым в процессе эволюции человекаОтчет идентифицировал последовательности IFN-λ4 у большинства видов млекопитающих, за заметным исключением грызунов 108 . Филогенетический анализ (рис. 4) показывает, что семейство IFN-λ4 составляет отдельную кладу в дереве IFN типа III. Напротив, IFN-λs 1–3 не образуют отдельные клады, а группируются по видам. Это предполагает, что предок млекопитающих имел ген IFNL4 -подобный и второй ген, который независимо дублировался несколько раз в ходе эволюции млекопитающих, давая начало IFNL1 , IFNL2 и IFNL3 .Таким образом, мышиный IFN-λ2 нельзя рассматривать как строгий ортолог человеческого IFN-λ2 и т. Д., Подобно тому, как это наблюдается для IFN-α.
Рисунок 4: Филогенетическое дерево IFN-λ, основанное на фактических или предсказанных белковых последовательностях.Мы отобрали виды так, чтобы они представляли разные ветви клады млекопитающих. Мы выбрали один вид сумчатых (серый короткохвостый опоссум; представляющий раннюю эволюцию млекопитающих) и три репрезентативных вида из надотряда Laurasiatheria (хорек, свинья, еж), а также мыши и человека, с которыми мы имеем дело в этом обзоре и представляют собой две основные ветви надотряда Euarchontoglires .Для анализа мы сохранили названия белков, найденные в базе данных NCBI, и добавили числа только к тем белкам, которые имели повторяющиеся имена. Последовательности были выровнены с использованием MUSCLE (http://www.ebi.ac.uk/Tools/msa/muscle/), и дерево было сгенерировано методом максимального правдоподобия на основе модели на основе матрицы JTT. Дерево нарисовано в масштабе, длина ветвей измеряется количеством замен на сайт.
Стоит отметить, что у людей IFN-λ4 имеет только ~ 30% идентичности с IFN-λ3, но, несмотря на низкую консервативность последовательности, он сохранил свою способность передавать сигналы 102 . Это показывает, что до появления «TT-псевдогенизирующего» аллеля у людей IFN-λ4 подвергался очищающей селекции, чтобы сохранить его способность передавать сигналы через рецепторный комплекс IFN-λ. Это было подтверждено биоинформатическим анализом, который обнаружил четкий очищающий отбор, действующий на все нечеловеческие гены IFNL4 108 . Мутация сдвига рамки считывания в человеческом IFNL4 была введена приблизительно 55 000 лет назад, как раз перед сценарием «За пределами Африки», и была положительно выбрана почти сразу же 108 .Это наблюдение поднимает несколько интересных вопросов. Почему IFNL4 внезапно превратилось в помеху? Что привело (и до сих пор является движущей силой) псевдогенизации IFNL4 ? Важно отметить, что IFNLR1 демонстрирует отбор против несинонимичных замен, демонстрируя явное эволюционное давление в пользу сохранения функциональной системы IFN типа III при специфической элиминации гена IFNL4 109 .
Это показывает, что до появления «TT-псевдогенизирующего» аллеля у людей IFN-λ4 подвергался очищающей селекции, чтобы сохранить его способность передавать сигналы через рецепторный комплекс IFN-λ. Это было подтверждено биоинформатическим анализом, который обнаружил четкий очищающий отбор, действующий на все нечеловеческие гены IFNL4 108 . Мутация сдвига рамки считывания в человеческом IFNL4 была введена приблизительно 55 000 лет назад, как раз перед сценарием «За пределами Африки», и была положительно выбрана почти сразу же 108 .Это наблюдение поднимает несколько интересных вопросов. Почему IFNL4 внезапно превратилось в помеху? Что привело (и до сих пор является движущей силой) псевдогенизации IFNL4 ? Важно отметить, что IFNLR1 демонстрирует отбор против несинонимичных замен, демонстрируя явное эволюционное давление в пользу сохранения функциональной системы IFN типа III при специфической элиминации гена IFNL4 109 .
Клиническое применение IFN типа III
Пегилированный IFN-λ1 впервые был запущен в клинические испытания против HCV, и первоначальный дизайн исследования был направлен на замену пегилированного IFN-α на пегилированный IFN-λ1.Успешное исследование фазы II показало, что IFN-λ1 был таким же или более эффективным, чем пегилированный IFN-α, и имел значительно меньше внепеченочных побочных эффектов 59 . Однако успешная разработка нескольких противовирусных препаратов прямого действия меняет терапевтический ландшафт для лечения ВГС, и, вероятно, в будущем IFN будет играть менее доминирующую роль. Однако в настоящее время проводится несколько испытаний фазы III, в которых пегилированный IFN-λ1 сочетается с противовирусными препаратами прямого действия (телапревир, асунапревир или даклатасвир).IFN типа III может представлять собой многообещающее противовирусное лечение в будущем при некоторых инфекциях с эпителиальным тропизмом, поскольку иммунопатологические побочные эффекты должны быть минимальными. IFN типа III может быть полезен в качестве терапии респираторных инфекций, вызванных вирусами, такими как вирус гриппа или коронавирусы (SARS и MERS) 74,110 , а также кишечной инфекции, вызванной норовирусами или ротавирусами 54 . Необходимы дальнейшие клинические исследования для проверки эффективности ИФН типа III против этих инфекций и изучения эффектов различных методов доставки.Однако открытие IFN-λ4 также является предостерегающим уроком, поскольку, по-видимому, в некоторых условиях IFN типа III может способствовать увеличению риска, а не защите от хронической инфекции.
IFN типа III может быть полезен в качестве терапии респираторных инфекций, вызванных вирусами, такими как вирус гриппа или коронавирусы (SARS и MERS) 74,110 , а также кишечной инфекции, вызванной норовирусами или ротавирусами 54 . Необходимы дальнейшие клинические исследования для проверки эффективности ИФН типа III против этих инфекций и изучения эффектов различных методов доставки.Однако открытие IFN-λ4 также является предостерегающим уроком, поскольку, по-видимому, в некоторых условиях IFN типа III может способствовать увеличению риска, а не защите от хронической инфекции.
Заключительные замечания
IFN типа III явно играет важную роль в защите эпителиальных поверхностей от вирусной инфекции, но еще предстоит решить ряд интересных вопросов. Учитывая, что эпителий легких отвечает как на IFN типа I, так и на тип III, каково распределение работы между этими системами IFN в респираторном эпителии? Люди часто сталкиваются с вирусами низкой или средней патогенности, и особой силой системы IFN типа III может быть ее способность бороться с этими инфекциями, не вызывая серьезного воспаления или повреждения тканей.Но выводы, сделанные из экспериментов с мышами в строго контролируемой лабораторной среде, рискуют игнорировать некоторые сложности, встречающиеся в реальной жизни. Поэтому, отвечая на будущие вопросы, исследователи должны рассмотреть возможность использования сложных моделей, которые учитывают вирусную и бактериальную коинфекцию, а также рецидивирующую инфекцию несколькими различными вирусами. Новые данные свидетельствуют о взаимодействии между IFN типа III и адаптивной иммунной системой, но как это происходит, пока не ясно. Можно представить себе прямые и косвенные эффекты IFN типа III через влияние на продукцию других цитокинов, таких как IL-12, или через воздействие на антигенпрезентирующие клетки.Будет интересно следить за развитием этой области в ближайшие годы. Роль парадоксального IFN-λ4 в семействе IFN типа III в настоящее время неясна. Существуют убедительные генетические доказательства того, что IFN-λ4 ингибирует выведение хронических вирусных инфекций, таких как HCV и CMV, но в настоящее время мало или совсем нет механистического понимания того, как это происходит.
Существуют убедительные генетические доказательства того, что IFN-λ4 ингибирует выведение хронических вирусных инфекций, таких как HCV и CMV, но в настоящее время мало или совсем нет механистического понимания того, как это происходит.
Интерферон — обзор | Темы ScienceDirect
Гены, белки и их индукция интерферона
Существует несколько типов и семейств интерферонов, каждый из которых обладает противовирусным действием.Текущая классификация основана на первичных структурах, а также на рецепторах-мишенях. По последнему критерию существует три типа IFN. IFN типа I включают несколько подтипов семейства IFN-α, IFN-β, IFN-ω, IFN-τ, IFN-κ и IFN-(35–39). Единственным IFN типа II является IFN-γ. Недавно открытые IFN типа III также известны как IFN-λ или IL-28/29; известно три члена, λ1 (IL-29) и λ2 / 3 (IL-28 A / B; 40). IFN типа III обладают структурной гомологией и характеристиками индукции с IFN типа I, хотя действуют через другой рецептор.
В генах IFN типа I отсутствуют интроны; 17 генов IFN типа I человека, включая многие кодирующие подвиды IFN-α, сгруппированы на хромосоме 9 (36–39). Соответствующие 13 мышиных генов сгруппированы на хромосоме 4. На уровне белка подвиды IFN-α человека имеют примерно 50% идентичности последовательностей; IFN-β составляет 22%, а IFN-ω на 37% идентичен IFN-α. Считается, что эти консервативные остатки опосредуют распознавание подобного рецептора этими белками. Белки IFN-α имеют от 186 до 190 аминокислотных остатков и содержат расщепляемый сигнальный пептид, в результате чего секретируется белок из 165 или 166 аминокислот.Две дисульфидные связи Cys-Cys сохраняются среди белков.
Ген, кодирующий IFN-γ, расположенный на хромосоме 12 человека и хромосоме 10 мыши, имеет три интрона и кодирует белок из 146 остатков, выполняющий функцию диммера (41,42). Структурная гомология IFN-γ с IFN типа I минимальна. NK-клетки являются основным источником IFN-γ, тогда как все типы клеток могут продуцировать IFN-α и IFN-β.
IFN типа I продуцируются преимущественно дендритными клетками, но также и Т-клетками, моноцитами, фибробластами и эпителиальными клетками.Выбор конкретных членов семейства, которые индуцируются, зависит как от типа клеток, так и от индуцирующего агента. Вирусная инфекция или продукты вирусных генов, такие как дцРНК, оцРНК, дцДНК или белки оболочки вируса, могут запускать синтез IFN типа I (43–45). Эти связанные с вирусными патогенами молекулярные паттерны (PAMP) распознаются специфическими мембраносвязанными белками, называемыми Toll-подобными рецепторами (TLR), которые инициируют процесс передачи сигналов, завершающийся синтезом IFN (Таблица 52-3). Двухцепочечная (ds) РНК, распространенный побочный продукт репликации вируса, распознается TLR3, белком, присутствующим в эндосомальной мембране (46).дцРНК также может распознаваться двумя цитозольными РНК-геликазами, RIG-I и Mda5. Вирусные одноцепочечные (оц) РНК распознаются TLR7 и TLR8, а вирусная ДНК — TLR9, все из которых также присутствуют в эндосомной мембране (43,45). Различные адаптерные белки соединяют эти рецепторные белки со специфическими протеинкиназами, такими как TBK1 и IKK, которые активируют факторы транскрипции, включая NF-κB, IRF-3, IRF-7 и AP-1. Для индукции гена IFN-β, NF-κB, необходим комплекс AP-1, состоящий из ATF2 / c-jun и либо IRF-3, либо IRF-7.Они образуют энханкосомный комплекс на промоторе гена (47,48). Синтез различных членов семейства IFN-α и IFN-β может быть замедлен во времени. IFN-β индуцирует синтез IRF-7, который, в свою очередь, индуцирует транскрипцию IFN-α1 и других генов IFN-α. Таким образом, синтез IFN и действие IFN тесно связаны; ингибирование передачи сигналов IFN блокирует устойчивую продукцию IFN-α. IRF5 может также участвовать в индукции гена IFN-α в определенных ситуациях. Бактериальные PAMP могут индуцировать синтез IFN с использованием других TLR, таких как TLR4, которые используют разные адаптерные белки, но активируют те же факторы транскрипции, что и TLR3.
Структура комплекса интерферон-рецептор определяется ограничениями расстояния из циклов двойных мутантов и гибкого стыкования
Abstract
Плейотропная активность интерферонов типа I приписывается специфическому взаимодействию IFN с компонентами рецептора клеточной поверхности ifnar1 и ifnar2. На сегодняшний день выяснена структура IFN, но не структура рецептора или комплекса. В этом исследовании структура комплекса IFN-α2-ifnar2 была создана с помощью процедуры стыковки с использованием ядерных ограничений расстояния, подобных эффекту Оверхаузера, полученных в экспериментах с циклами двойных мутантов.Свободную энергию взаимодействия между 13 остатками лиганда и 11 рецептора измеряли с помощью циклов двойных мутантов. Было обнаружено, что из 100 исследованных парных взаимодействий взаимодействуют пять пар остатков. Эти пять взаимодействий были включены в качестве ограничений расстояния в гибкую программу стыковки prodock с использованием фиксированных и подвижных сеток градиента энергии, прикрепленных к рецептору и лиганду, соответственно. Многовариантная минимизация и минимизация Монте-Карло стыковка IFN-α2 с ifnar2 привели к четко определенной средней структуре с соблюдением пяти ограничений расстояния.Кроме того, не наблюдалось никаких структурных артефактов или напряжения внутри петли. Сайты взаимного связывания IFN-α2 и ifnar2, предсказанные на основе модели, показали почти полную суперпозицию с сайтами, определенными в исследованиях мутагенеза. На основе этой структуры обсуждаются различия в связывании IFN-α2 и IFN-β.
Интерфероны I типа (ИФН) представляют собой семейство гомологичных цитокинов, которые эффективно вызывают антивирусное и антипролиферативное состояние клеток. Все IFN типа I человека (IFN-α, -β и -ω) связываются с рецептором клеточной поверхности, состоящим из двух трансмембранных белков, IFN-рецептора I типа (ifnar) 1 (1) и ifnar2 (2), которые связываются при связывании .IFN связывается с высокой аффинностью с ifnar2, вероятно, впоследствии рекрутируя ifnar1. IFN типа I относятся к классу спиральных цитокинов и состоят из пяти спиралей. Структуры человеческого IFN-α2 (3) и IFN-β были разрешены (4). Структуры рецепторов неизвестны, но могут быть смоделированы путем гомологии с рецепторами цитокинов человека с известными структурами, такими как тканевой фактор (5) и рецептор IFN-γ (6). Мутационные исследования выявили сайты взаимного связывания на IFN-α2 и ifnar2. На IFN-α2 ifnar2 связывается со спиралью A (остатки 12–15), петлей AB (остатки 26–35) и спиралью E (остатки 144–153) (7), тогда как на ifnar2 IFN-α2 связывает к трем петлям N-концевого домена рецептора (остатки 45–52, 75–82 и 102–106) без значительного связывания с С-концевым доменом (8–10).Определение структуры рецептор-лиганд будет значительно способствовать нашему пониманию передачи сигналов IFN на молекулярном уровне.
Стыковка белковых комплексов и расчет конформационных изменений, которые происходят в интерфейсе связывания, представляют собой вычислительную задачу. Программные алгоритмы стыковки жестких белков являются быстрыми и могут использоваться для стыковки двух белков, для которых ЯМР или рентгеновские структуры были решены независимо (11, 12). Однако успешный докинг основан на сходстве несвязанных и сложных белковых структур, поскольку точное предсказание глобальных и локальных конформационных изменений в настоящее время затруднено (13).Без него для определения взаимодействующих поверхностей необходима дополнительная информация из исследований мутагенеза, генетических исследований или биоинформатики. Большинство этих методов не обеспечивают относительную ориентацию двух белков, а только определяют расположение сайтов связывания. Эта проблема может быть решена с помощью более совершенной процедуры мутагенеза, в которой пары остатков (X и Y, расположенные на белках E 1 и E 2 , соответственно) мутируют как одиночно, так и дважды, что позволяет конструировать двойной мутантный цикл (DMC) (14, 15).Предполагая, что взаимодействуют только соседние остатки, этот метод можно использовать для определения ограничений расстояния между двумя белками. Чтобы убедиться, что значительная свободная энергия взаимодействия (ΔΔ G int ) обнаруживается в основном между соседними остатками, связь между расстоянием и свободной энергией взаимодействия была оценена для 71 парного взаимодействия между остатками, для которых оба значения ΔΔ G int и структура при атомном разрешении известны (данные взяты из исх.16–20). В большинстве случаев (39 из 42) значения ΔΔ G int > 2,5 кДж / моль были определены между соседними парами остатков ( d <5 Å). Тем не менее, не было обнаружено благоприятной свободной энергии взаимодействия между всеми соседними остатками; в девяти из 38 случаев, когда свободная энергия взаимодействия была меньше 2,5 кДж / моль, расстояние между остатками было меньше 5 Å. Следовательно, правильно предположить, что благоприятные энергии взаимодействия, определенные по ДМК, относятся в основном к соседним остаткам.Однако отсутствие значительной свободной энергии взаимодействия не означает, что эти два остатка удалены друг от друга. Это соотношение расстояние / свободная энергия является основой для разработки метода стыковки с ограничением расстояния, применяемого здесь для стыковки комплекса IFN-α2-рецептор.
Данные DMC ранее использовались для грубой стыковки пептидного ингибитора с порой канала K + , пептида с антителом и лиганда с рецептором (21–23). Новшеством в настоящей работе является адаптация информации о мутагенезе к ограничениям расстояния между остатками в стиле ЯМР и использование этих ограничений для вычислительного управления стыковкой.Данные DMC используются для точной стыковки белок-белкового комплекса. Моделирование стыковки основано на минимизации нескольких пусков или минимизации Монте-Карло (MCM), с различными шагами для уравновешивания оптимизации экспериментальных ограничений и энергии ECEPP / 3 в гибком интерфейсе. Пристыковка IFN-α2 к ifnar2 с использованием обоих методов позволила получить четко определенную среднюю структуру с соблюдением пяти определенных ограничений расстояния.
Методы
Экспрессия и очистка белков.
IFN-α2 и ifnar2-внеклеточный домен (EC) были экспрессированы в Escherichia coli и очищены, и их концентрации были определены, как описано (7, 24).
Сайт-направленный мутагенез.
Сайт-направленный мутагенез выполняли с помощью ПЦР-амплификации полных плазмид для экспрессии с 18-21 нуклеотидными праймерами, содержащими мутантный кодон, с использованием высокоточных полимераз pwo (Roche Diagnostics) и pfu (Stratagene), как описано ( 10).
Обмеры привязки
.Взаимодействия Ifnar2-EC – IFN-α2 отслеживались с помощью оптического зонда без меток (рефлектометрическая интерференционная спектроскопия), который обнаруживает бимолекулярное взаимодействие на границах раздела в реальном времени в условиях проточного потока (25). Описана экспериментальная установка (25). Все измерения проводились с использованием 20 мМ Hepes (pH 7,5), 150 мМ NaCl и 0,01% Triton X-100 в качестве рабочего буфера. Ifnar2-EC был иммобилизован на поверхности с использованием ненейтрализующего mAb 46 против ifnar2-EC.10 с последующим перекрестным связыванием вторым mAb (117,7) (подарок Даниэлы Новик, Институт Вейцмана) (7, 25). Кривые связывания оценивали с помощью программного обеспечения для оценки биологических проб (Biacore, Uppsala) с использованием простой однозначной кинетической модели. Для определения (равновесных) констант диссоциации K D отклик равновесия был нанесен на график в зависимости от концентрации и подогнан по закону действия масс.
DMC.
. Свободную энергию взаимодействия между двумя аминокислотными остатками ΔΔ G int определяли по изменению свободной энергии взаимодействия при мутации ΔΔ G согласно уравнению.1: 1 с i и j , представляющими остатки дикого типа, и 0 , представляющими соответствующий мутант Ala (15). Значения ΔΔ G определяли из констант скорости диссоциации ( k d ) для мутантов, для которых k d <0,3 с -1 . В этом случае ΔΔ G k d рассчитывается по (12, 18): 2 Для более быстро диссоциирующих пар мутантный лиганд-рецептор кинетика диссоциации не может быть определена с помощью рефлектометрической интерференционной спектроскопии.Для этих случаев (равновесная) константа диссоциации K D была использована вместо k d для расчета ΔΔ G (ΔΔ G K D ). Значения ΔΔ G (и, следовательно, ΔΔ G int ), определенные с использованием k d или K D , были согласованными (25), что указывает на то, что потенциальные систематические ошибки устраняются, когда рассчитаны относительные значения (ΔΔ G ) (16, 25).SEM для ΔΔ G оценивается как 0,75 кДж / моль (каждый мутант измерялся не менее трех раз). Соответственно, стандартная ошибка 1,0 кДж / моль оценивается для ΔΔ G int . Пороговое значение 2,5 кДж / моль использовали для определения значимости взаимодействия между парой остатков.
Молекулярный докинг.
Процедура стыковки, основанная на ограничениях расстояния, полученных из DMC, будет представлена в следующей статье (J.-Y.T. и H.A.S., неопубликованная работа), поэтому они кратко описаны здесь.
Справочные структуры.
ЯМР-структура IFN-α2 [код банка данных белков 1ITF (3)] и модель ifnar2-EC, основанная на его гомологии с рецептором IFN-γ и тканевым фактором (10), были использованы для этого исследования. Перед стыковкой структурные элементы сохраняли гибкость во время стыковки [IFN-α2 (D2-E42, E141-E146, M148-S160) и ifnar2-EC (L44-V57, W74-V82, C97-M107, V127-Q138, K155- N167, E188-Q193)] были регуляризованы до стандартной геометрии и минимизированы по энергии независимо с использованием силового поля ECEPP / 3 (26), чтобы избежать высокой энергии контура в начале стыковки.
Молекулярная система.
Каждая молекула была разделена на гибкую и фиксированную части. Гибкая часть включала все остатки, которые находятся на границе связывания [60 для IFN-α2 и 65 для ifnar2-EC (см. Выше)]. Полная энергия белкового комплекса была выражена как: 3 E inter представляет собой взаимодействия ECEPP / 3 между жесткими или гибкими остаточными сегментами, E intra представляет собой внутримолекулярную энергию гибких сегментов, E dist представляет собой энергию ограничения расстояния между остатками, E рентгеновское излучение представляет собой ограничение рентгеновского излучения тяжелых атомов гибких структурных элементов в исходной структуре IFN-α2 с минимальной энергией и ifnar2 (чтобы предотвратить их разворачивание во время стыковки), а E петля — ограничение замыкания петли (27).Веса (λ) использовались для уравновешивания движущей силы, выраженной здесь ограничениями расстояния и другими терминами, особенно внутримолекулярной и межатомной энергией ECEPP / 3. Некоторые были исправлены во время процедуры стыковки: (λ inter = 1, λ intra = 1, λ dist = 30, λ loop = 1000), а некоторые были изменены во время моделирования: λ рентген = 100, 10, 0 для трех последовательных улучшений минимизации энергии в данном стыковочном запуске. Значения этих весовых коэффициентов были оценены как a priori как , гарантируя, что ни одно из внешних ограничений (в частности, E dist ) не превышает энергетические члены ECEPP / 3 более чем на 2–3 порядка величины.
Ограничения расстояния.
Энергетический термин ограничения расстояния аналогичен тому, который используется для оптимизации ограничения расстояния ядерного эффекта Оверхаузера (28). Гармоническая сила накладывалась, когда нарушение расстояния было больше, чем заданное пользователем минимальное расстояние, то есть 5 Å для первых шагов минимизации и 3 Å для следующих двух шагов минимизации. Если нарушение было больше 2 Å от минимального расстояния, гармоническое расстояние заменялось квазилинейной ветвью (29).
Энергетические и градиентные сетки.
ECEPP / 3 Ван-дер-Ваальса и электростатические вклады замороженных частей как рецепторных, так и лигандных белков хранили в трехмерных сетках. Рецепторная сетка была фиксированной (т.е. не допускались никакое перемещение или вращение), и лигандной сетке позволяли перемещаться вместе с лигандом как твердое тело. Схема экстраполяции B-сплайна использовалась для обеспечения непрерывности внутри сетки и облегчения минимизации на основе градиента (30–32).Эти две сетки ускоряют моделирование стыковки примерно на два порядка в зависимости от размера системы.
MCM.
Возмущения двугранных углов, а также вращение и трансляция лиганда производились по нормальным модам системы (32). Амплитуда возмущения (размер шага) была такой, что 10% двугранных углов боковой цепи и 1% двугранных углов основной цепи могли значительно перемещаться (примерно на 30-60 °) между 0.2 и 2 Å для трансляции и от 10 ° от до 30 ° для угла поворота. Для MCM была выбрана температура 1000 К. Количество итераций для каждой минимизации составляло 300 для первых 500 шагов MCM и 600 для последних 100 шагов MCM. После прогонов MCM была проведена полная минимизация (6000 шагов итераций) с λ рентген = 0,1, со всеми другими весовыми коэффициентами, как и раньше.
Перед внедрением для стыковки IFN-α2 с ifnar2 алгоритм был протестирован на взаимодействии между barnase и barstar, для которого доступны данные DMC и соответствующие структуры (20, 33).Было оценено влияние нескольких параметров на качество результатов, в частности, количества используемых ограничений расстояния, эффекта использования неправильных ограничений расстояния, веса члена штрафа за расстояние и положения исходных конформаций. Результаты показывают, что моделирование относительно стабильно с использованием 4–9 ограничений расстояния, даже если ошибочное ограничение было введено намеренно. Значение среднеквадратичного отклонения (rmsd) стыкованной структуры составляло ≈2 Å относительно кристаллографически определенной структуры (J.-Y.T. и имеет. , неопубликованные работы). Среднеквадратичные значения в этой работе являются средними среднеквадратичными значениями всех основных атомов. В случае рецепторного комплекса IFN-α2 все структуры ifnar2 были перекрыты, и было вычислено среднее среднеквадратичное значение всех атомов основной цепи IFN-α2.
Результаты
Анализ DMC интерфейса IFN-α2 – ifnar2.
Соответствующие сайты связывания IFN-α2 и ifnar2 были ранее картированы посредством сайт-направленного мутагенеза (7, 10).Здесь мы расширили эти исследования, выполнив систематический DMC-анализ интерфейса. Поскольку структура комплекса неизвестна, потенциальные взаимодействия между 13 остатками IFN-α2 и 11 остатками ifnar2, которые расположены внутри эпитопов взаимного связывания, систематически исследовали с использованием DMC (Таблица 1 и Рис. 1; Таблицы 2. и 3, которые публикуются в качестве вспомогательной информации на веб-сайте PNAS www.pnas.org). Анализы связывания проводили методом гетерогенной фазовой детекции с помощью рефлектометрической интерференционной спектроскопии с иммобилизацией ifnar2-EC на поверхности (25).Свободные энергии взаимодействия были рассчитаны с использованием последовательно либо k d , либо K D для любого одного DMC (см. методы ).
Таблица 1Свободные энергии взаимодействия, определенные из DMC с использованием соответствующих мутаций
фигура 1DMC-анализ комплекса IFN-α2 – ifnar2. Значения ΔΔ G int , определенные из изменений k d или K D , представлены в виде круглых и квадратных полос соответственно.Данные взяты из таблицы 1. ( A ) Рассчитанные значения ΔΔ G int для остатков, где было идентифицировано межбелковое взаимодействие (ΔΔ G int > 2,5 кДж / моль). ( B ) Рассчитанные значения ΔΔ G int для остатков, где не было идентифицировано межбелковое взаимодействие.
Значения ΔΔ G int , определенные по изменению k d или K D , представлены на рис.1 как круглые и квадратные стержни соответственно. В случае сомнений были рассчитаны оба значения (см. Таблицы 1–3), что дало аналогичные результаты. Фиг.1 A показывает те остатки, для которых было идентифицировано по крайней мере одно межбелковое взаимодействие (ΔΔ G int > 2,5 кДж / моль). Фиг.1 B показывает рассчитанные значения ΔΔ G int для остатков, для которых не было идентифицировано очевидного взаимодействующего партнера. Из 90 значений DMC, представленных на рис.1, только пять выше 2.5 кДж / моль, что здесь определено как значительное. На IFN-α2 три взаимодействующих остатка расположены на спирали E (R144, R149 и S152), а два — на петле AB (F27 и D35). Несмотря на большие усилия, не было обнаружено парных взаимодействий с участием L30 или R33 (данные не показаны для R33A, потому что очень низкая аффинность этого мутанта значительно увеличивает ошибку этих измерений) или R12 и L15, которые расположены на Спираль IFN-α2 и была идентифицирована для связывания ifnar2 (7).На ifnar2 три остатка, взаимодействующие с IFN-α2, расположены на петле 45–52 (Y45, M48 и K50), а два — на петле 76–79 (H78 и E79). Не было обнаружено парных взаимодействий с участием остатков W102, I105 или D106, которые расположены на петле, соединяющей первый и второй IgG-подобный домен на ifnar2. Наибольшая свободная энергия взаимодействия (ΔΔ G int = 8 кДж / моль) была определена между R149 (IFN-α2) и E79 (ifnar2). Эти два остатка расположены в центре их соответствующих связывающих поверхностей, и оба ранее были определены как горячие точки для связывания.Второе взаимодействие, соединяющее спираль E IFN-α2 с ifnar2, происходит между R144 (IFN-α2) и M48 (ifnar2). Третье взаимодействие (S152-H78) соединяет спираль E (IFN-α2) с петлей 76–79 ifnar2, образуя потенциальную водородную связь. В петле AB (IFN-α2) F27, вероятно, образует ароматическое взаимодействие с Y45 (ifnar2), а D35 (IFN-α2) образует потенциальный солевой мостик с K50 (ifnar2). Хотя последние три пары остатков не являются остатками горячих точек, их свободные энергии взаимодействия все еще> 2.5 кДж / моль и значительно больше измеренного фона (других парных взаимодействий с участием этих остатков).
Определение структуры комплекса IFN-α2 – ifnar2.
Пристыковка IFN-α2 (структура ЯМР 1ITF) к модели ifnar2 была проведена с использованием двух методов: многозадачной четырехэтапной минимизации (10 независимых прогонов) и мультизагрузочной модели MCM (пять независимых прогонов). Начальными точками были случайные положения и ориентации лиганда примерно на 15 Å выше области связывания на рецепторе.В первом подходе использовались три шага минимизации, чтобы сбалансировать движущую силу ограничения расстояния и энергию ECEPP / 3 по мере приближения лиганда к рецептору. Четвертый этап был выполнен без ограничений по расстоянию и рентгеновскому излучению. Десять минимизаций совпали со средним среднеквадратичным значением 1,6 Å между ними (рис. 2 A ). Каждое из пяти ограничений расстояния было выполнено с нарушением менее 0,5 Å во всех 10 сложных структурах (рис. 2 B ).
Рисунок 2Структура комплекса IFN-α2 – ifnar2.Структура была рассчитана с использованием либо минимизации мультистарта, либо мультистарта MCM, сохраняя гибкость некоторых магистральных и боковых цепей (см. методы ). ( A ) Ленточная структура комплекса из 10 независимых экспериментов по стыковке (минимизация, черный и красный; MCM, коричневый и зеленый) и использование только первого домена ifnar2 (синий). ( B ) Ленточная структура комплекса; показаны 10 остатков, которые вносят вклад в пять ограничений расстояния. ( C ) Вид комплекса сзади, с буквами, обозначающими спирали и петлю AB IFN.
Потенциальная проблема с процедурой минимизации состоит в том, что она может не допустить больших структурных перестроек. Чтобы проверить это, было проведено пять независимых многозадачных моделей MCM, начиная с тех же случайных структур. Все эти прогоны MCM сходились, хотя и с большими колебаниями между отдельными структурами (среднее среднеквадратичное значение 2,8 Å). Структуры, полученные при моделировании MCM, очень близки к структурам, полученным с помощью четырехэтапной процедуры минимизации (рис.2 А ).
Обсуждение
DMC измеряют свободную энергию связывания между двумя аминокислотами. Метод был разработан для деконволюции термодинамики системы и соотнесения ее с доступной структурной информацией (15, 28). Однако было признано, что данные DMC также могут служить для указания структурной близости (22, 23). Здесь мы использовали данные DMC для обеспечения ограничений по расстоянию, которые включены в программу молекулярного стыковки, разработанную для моделирования межбелковых взаимодействий при отсутствии достаточно хороших структурных данных.
Пять идентифицированных межбелковых взаимодействий были использованы для закрепления IFN-α2 на ifnar2 с использованием двух методов расчета. Вычислительный более быстрый метод использует минимизацию энергии ограничения расстояния, ослабление ограничений рентгеновского излучения и расстояния в ходе моделирования. Структуры, полученные из 10 отдельных симуляций, сходятся, что позволяет предположить, что пристыкованный комплекс не зависит от исходного положения лиганда. Более того, ослабление всех ограничений расстояния в конце моделирования не привело к значительному уменьшению энергии ECEPP / 3 или движения конструкции.Таким образом, ограничения расстояния не привели к смещению структуры в сторону нереалистичных режимов привязки. Недостатком метода минимизации является то, что он может быстро оптимизировать ограничения расстояния, не исследуя должным образом конформационное пространство гибких доменов. Чтобы преодолеть эту проблему, было проведено пять симуляций MCM. В конце прогонов MCM пять структур сходились к аналогичной уникальной средней структуре, которая была получена ранее с помощью четырехэтапной процедуры минимизации, однако с большим среднеквадратичным значением между ними.
Фактически вероятно, что сходимость структур напрямую коррелирует с качеством выбора остатков, участвующих в ограничениях расстояния, и что структуры представляют собой наилучшую оценку комплекса IFN-α2 – ifnar2. Независимо от этих экспериментов по стыковке сайты взаимодействия на IFN-α2 и ifnar2 были исследованы с помощью единичного мутагенеза (9–12). Хорошее соответствие между активными сайтами, определенными из единичного мутагенеза, и интерфейсом связывания обеспечивает экспериментальную оценку качества модели (рис.3). Большинство остатков, влияющих на связывание при мутации, расположены в пределах предлагаемого интерфейса, включая все «горячие точки». Исключение составляют T46 и D106 на ifnar2. В модели ifnar2 оба этих остатка скрыты под остатками, непосредственно участвующими в связывании, что предполагает косвенный вклад этих остатков в связывание. Ряд остатков, расположенных на краю предполагаемой границы связывания, не вносят значительного вклада в аффинность связывания. К ним относятся M16, R22 и I24 на IFN-α2 и E52 и N100 на ifnar2.Однако хорошо известно, что остатки, расположенные на периферии сайта связывания, часто инертны (34). Более того, мутации любого из этих остатков вызывают небольшое, но значительное изменение в k d комплекса (7, 10) (но менее чем в 2 раза, что является порогом, используемым на рис. 3). . Анализ степени сохранения интерфейсных остатков между различными подтипами IFN-α показывает, что функциональные остатки горячих точек (номера 30, 33, 144, 145, 148 и 149) полностью консервативны.Остальные интерфейсные остатки сохраняются лишь частично. Для ifnar2 гомология последовательности с другими рецепторами цитокинов человека невысока, поэтому консервация не ожидается и не обнаружена.
Рисунок 3Сравнение сайтов взаимного связывания IFN-α2 и ifnar2, определенных из мутагенеза, с границей раздела структуры комплекса. Структура комплекса была раскрыта путем поворота IFN-α2 на 180 °. Пороговое значение для интерфейсных остатков составляет 5 Å. Активные остатки определяются как остатки, для которых мутация Ala вызывает снижение аффинности связывания по меньшей мере в 2 раза.Остатки сайта связывания были разделены на те, которые взаимодействуют с C-концевым доменом ifnar2-EC (оранжевый и синий) и N-концевым доменом ifnar2-EC (все другие цвета). Красные активные остатки, расположенные внутри сайта связывания. Желтые, неактивные остатки, расположенные в сайте связывания. Пурпурный — остатки, расположенные в сайте связывания, для которых активность не определялась. Коричневые активные остатки, расположенные за пределами сайта связывания. Синий — остатки, расположенные внутри сайта связывания второго домена ifnar2, но не связывающие активные.Оранжевый, остатки, расположенные внутри сайта связывания и второго домена ifnar2, но активность которых не измерялась.
Структура комплекса IFN-α2 – ifnar2 предполагает, что IFN-α2 взаимодействует с обоими доменами ifnar2 (рис. 2 и 3). Этот способ связывания согласуется с таковым, обнаруженным для других рецепторов цитокинов человека, таких как IL4-R, рецептор гормона роста человека и рецептор IFN-γ (6, 35), но не подтверждается исследованиями мутагенеза IFN-α2. Комплекс –ifnar2 (рис.3) (8–10). Ни одна из 16 одиночных мутаций, введенных во второй домен ifnar2, не вызвала снижения аффинности более чем в 2 раза (8-10). Более того, усеченный ifnar2, лишенный второго домена, связывает IFN-α2 с разумной аффинностью (неопубликованные данные). Угол между двумя доменами ifnar2 моделировали с использованием рецептора IFN-γ в качестве матрицы. Но из-за большого разброса этого угла между разными рецепторами цитокинов человека (35) нельзя быть уверенным, что модель ifnar2 верна в этом отношении.Другая относительная ориентация между двумя доменами ifnar2 сместила бы второй домен от сайта связывания IFN. Чтобы определить, будет ли рассчитанная структура интерфейса IFN-α2 – ifnar2 отличаться в отсутствие второго домена, моделирование стыковки было повторено с использованием только первого домена ifnar2 (синяя линия на рис. 2 A ). Структура этого комплекса аналогична структуре целого белка ifnar2. Площадь скрытой поверхности между IFN-α2 и ifnar2 в предлагаемой модели составляет 2450 Å 2 для взаимодействий обоих доменов ifnar2 с IFN-α2 и 1600 Å 2 для взаимодействий только первого домена ifnar2 с IFN-α2. .Оба значения находятся в пределах ожидаемого диапазона белок-белковых взаимодействий (36). Таким образом, способ взаимодействия второго домена ifnar2 с IFN-α2 остается неопределенным.
Наиболее выдающейся структурной особенностью интерфейса IFN-α2 – ifnar2 является глубокая вставка петли 45–52 ifnar2 в бороздку, образованную вокруг Ala-145 на IFN-α2 (рис. 4). Три ограничения расстояния соединяют эту петлю с IFN-α2 (рис. 2 B и 4). Исследования одиночных мутаций показали, что эта бороздка находится в центре связывающего эпитопа, с четырьмя активными остатками IFN-α2, расположенными по ее краю (7).Таким образом, неудивительно, что остатки горячих точек (T46, I47 и M48) расположены вдоль петли ifnar2, которая проникает в IFN-α2. Более пристальный взгляд на взаимодействия, производимые этой петлей, показывает, что атомы кислорода основной цепи S49 и K50 (ifnar2) образуют две потенциальные водородные связи с боковой цепью R33. Это открытие может объяснить, что никакие взаимодействующие остатки не были идентифицированы для R33, несмотря на его значительный вклад в связывание. Вторая важная детерминанта связывания находится между центральной частью спирали E IFN-α2 (R149 и S152) и петлей 76–82 ifnar2 (включая E79 и H78, которые связывают R149 и S152).Хотя эта петля ifnar2 связывает плоскую часть поверхности IFN-α2, она имеет большое значение для связывания, о чем свидетельствует большая свободная энергия связывания между R149 и E79. Не было обнаружено экспериментальных парных взаимодействий ни на спирали А IFN-α2, ни на петле 102–106 ifnar2. Интересно, что эти два домена вторичной структуры находятся в непосредственной близости в модели, что может объяснить их вклад в аффинность связывания, определяемую мутагенезом.
Рисунок 4Увеличенное изображение сайта связывания IFN-α2 – ifnar2.Поверхность IFN-α2 окрашена в соответствии с расстоянием от ifnar2 (пурпурный <3 Å, белый <4 Å). Следует отметить проникновение петли 45–52 ифнара2 в бороздку на поверхности IFN-α2.
IFN-β взаимодействует с ifnar2 с таким же набором остатков, что и IFN-α2, но с очень разными значениями ΔΔ G при мутации (9, 10). Заманчиво попытаться объяснить эту разницу, используя модель, созданную здесь, предполагая, что IFN-β связывается с тем же эпитопом ifnar2, что и IFN-α2.На фиг. 5 IFN-β был наложен на IFN-α2 в комплексе с ifnar2. Анализ различий между двумя взаимодействующими эпитопами показывает, что W22 (IFN-β), который заменяет A19 (IFN-α2), потенциально прочно связывает W102 ifnar2. Это могло бы объяснить, почему W102 является горячей точкой для связывания IFN-β, но не IFN-α2. Было бы интересно проверить эту гипотезу экспериментально. Второй сайт, в котором наблюдалось большое отклонение между IFN-β и IFN-α2, — это мутация R35A в IFN-β, которая вызывает снижение связывания только в 10 раз, тогда как гомологичная мутация в IFN-α2 (R33A ) вызывает уменьшение связывания в 10000 раз (7).Это явление теперь можно объяснить разницей в угловой ориентации этих двух остатков. Хотя R33 (IFN-α2) образует две водородные связи в основной цепи с петлей 45–52 ifnar2, R35 (IFN-β) указывает в сторону от ifnar2. Другое интересное различие, показанное на фиг. 5, относится к глубине бороздки вокруг A145, который является валином в IFN-β. Это может объяснить меньшую важность M48 (ifnar2) в связывании IFN-β (12).
Рисунок 5Сравнение сайтов связывания IFN-α2 и потенциальных IFN-β для ifnar2.IFN-β (атомы с заполненным пространством) накладывали на IFN-α2 (показан как доступная для растворителя поверхность). Сайт связывания N-концевого домена ifnar2 на IFN-α2 окрашен в зеленый цвет. Места, в которых выступает IFN-α2 или IFN-β, представлены как поверхностные атомы или атомы, заполненные пространством, соответственно.
Предлагаемая структура IFN-α2 – ifnar2 представляет собой модель, созданную методом ЯМР с использованием экспериментально определенных ограничений расстояния. По этой причине его надежность существенно выше, чем у теоретической стыковки.Сходимость стыкованных структур показывает, что определенный комплекс уникален, т. Е. Количество ограничений расстояния было достаточным, чтобы привести к сходящейся средней структуре. Однако из-за небольшого количества ограничений его качество не соответствует качеству структуры, определенной с помощью рентгеновских лучей или ЯМР. Следовательно, не следует ожидать атомарного разрешения; тем не менее, он обеспечивает понимание структуры интерфейса и сформированных межбелковых контактов. Помимо структурных данных, этот метод предоставляет полезные термодинамические данные об окружающей среде.Представленный здесь метод предлагает альтернативу для определения структуры белок-белковых взаимодействий, когда структурная характеристика таких комплексов не может быть проведена.
Благодарности
Эта работа была поддержана грантом № 96-00439 / 1 от Американо-израильского фонда двусторонних исследований и грантом GM-14312 Национальных институтов здравоохранения. Поддержка также была получена от Национального фонда исследований рака. Г.С. является председателем кафедры развития карьеры Дьюи Дэвида Стоуна и Гарри Левина.J.P. был докторантом Европейской организации молекулярной биологии в 1998 и 1999 годах.
Сноски
↵ † Нынешний адрес: Филиппский университет в Марбурге, Институт физиологической химии, Karl-von-Frisch-Straße 1, 35033 Марбург, Германия.
↵¶ Кому следует обращаться с запросами на перепечатку. Эл. Почта: bcges {at} weizmann.ac.il.
Этот документ был отправлен напрямую (Трек II) в офис PNAS.
Сокращения
- DMC,
- цикл двойных мутантов;
- ifnar,
- рецептор IFN типа I;
- EC,
- внеклеточный домен;
- MCM,
- Минимизация Монте-Карло;
- среднеквадратичное отклонение,
- среднеквадратичное отклонение
- Авторские права © 2001, Национальная академия наук
Зона Златовласки интерферонов типа I: уроки генетики человека
Введение
Классически обнаружение молекулярных паттерны (PAMP) разнообразной сети цитоплазматических и мембраносвязанных рецепторов распознавания паттернов (PRR) рассматриваются как основной пусковой механизм для продукции гетерогенной группы растворимых цитокинов, ответственных за активацию провоспалительных и противовирусных эффекторов, которые «мешают» репликации вируса .Соответствующим образом названные IFN образуют три семейства цитокинов: IFN типа I (IFN-Is) (α / β), IFN типа II (IFN-II) (γ) и IFN типа III (IFN-III) (λ). Семейство IFN-I состоит из 13 частично гомологичных α-подтипов, одного β-подтипа и шести других генных продуктов (IFN-ε, IFN-τ, IFN-κ, IFN-ω, IFN-δ и IFN-ζ), которые: вместе с четырьмя подтипами IFN-III создают эффективное, быстродействующее и мощно усиленное оружие в иммунных ответах на вторжение клеток микробами (1, 2). IFN-Is участвуют как в аутокринной, так и в паракринной передаче сигналов через канонический путь передачи сигналов JAK / STAT, чтобы индуцировать высокоэффективные антипролиферативные и противовирусные эффекторы.Однако эти ответы имеют негативные последствия для хозяина, и поэтому система IFN строго регулируется. Генетические исследования человека показали, как нарушение регуляции системы IFN-I может приводить к аутовоспалительным осложнениям различной степени тяжести, известным под общим названием интерферонопатии I типа (3, 4). Напротив, нарушение индукции IFN-I или нижестоящего сигнального каскада делает людей восприимчивыми к определенным вирусным инфекциям, включая те, которые обычно не связаны с заболеванием.Эта дихотомия подчеркивает критически важный баланс, необходимый для воспалительного ответа, вызванного IFN, для безопасного ограничения инфекции без значительной токсичности. Следовательно, зона IFN-I «Златовласка», как определено генетикой человека, вероятно, существует при впечатляюще низком уровне активности, связанной с IFN. Путем включения в уравнение переменной пенетрантности, связанной с этими состояниями, в этом обзоре исследуются механизмы, которые компенсируют дефекты и нарушение регуляции пути IFN-I. Полученные знания могут не только направлять лечение этих синдромов, но также могут повлиять на разработку нового поколения противовирусных и противовоспалительных терапевтических средств (рис.1).
РИСУНОК 1.Спектр заболеваний, связанных с дисрегулируемым IFN-I-опосредованным воспалением, определяет зону IFN Goldilocks для безопасной противовирусной устойчивости широкого спектра действия. ( A ) Выживаемость и приблизительный уровень IFN-связанного воспаления, возникающего при генетической недостаточности системы IFN. Дефицит STAT1 определяет нижний предел, тогда как дефицит USP18, наряду с тяжелым AGS, представляет собой верхний предел выживаемой активности, связанной с IFN. Уровень активности IFN-I у лиц с дефицитом ISG15 попадает в зону IFN Goldilocks, диапазон, который безопасно и эффективно усиливает защиту от всех вирусных инфекций, протестированных на сегодняшний день.( B ) Дефекты отрицательной регуляции IFN-I приводят к постоянной активности IFN-I. При дефиците ISG15 и USP18 реакция на первоначальное микробное поражение является нормальной. Пиковая активность IFN сравнима со здоровыми людьми, но отсутствие ISG15 или USP18 препятствует полному разрешению этого воспаления, и в результате люди с дефицитом ISG15 и USP18 проявляют стойкую опосредованную IFN-I активность. У пациентов с дефицитом ISG15 наблюдается ~ 1% предполагаемого пикового воспаления IFN-I только от небольшой подгруппы ISG.Это слегка усиленное воспаление способствует усилению способности бороться с вирусными инфекциями. Таким образом, дефицит ISG15 определяет целевой уровень терапевтически индуцированной связанной с IFN активности, эффективного диапазона IFN-опосредованного воспаления, которое хорошо переносится в течение длительного периода времени. Этот диапазон должен служить целью для разработки и уточнения терапевтических средств на основе IFN.
История и предыстория IFN-I
Открытие IFN-Is в качестве противовирусных агентов в середине и конце 1950-х годов произвело революцию в нашем понимании того, как бороться с вирусными инфекциями (5, 6).Очистка цитокинов IFN-I в конце 1970-х и начале 1980-х (7-11) и создание мышей с нокаутом IFN-I (α / β) рецептора (IFNAR) в 1990-х годах укрепили надежную противовирусную функцию цитокина, описанного ранее. in vitro (12). Инь этого янь заключалась в постепенном осознании того, что IFN-I может быть вредным для хозяина. Эксперименты, проведенные на мышах в 1970-х и 1980-х годах, показали, что IFN-I потенциально нейротоксичен для развивающихся мышей, а также может вызывать повреждение почек (13, 14).Дополнительные побочные эффекты были позже подтверждены у людей при применении IFN-I в качестве терапевтического агента при гепатите C и рассеянном склерозе (15, 16).
Между тем, молекулярные механизмы и функции IFN-Is постепенно расшифровывались. К концу 1980-х и началу 1990-х канонический путь передачи сигналов IFN-I был определен. Инфекция подвергает клетки-хозяева воздействию PAMP, которые стимулируют PRR, расположенные на плазматической мембране, в эндосомных компартментах и в цитоплазме. Эти PRR, в свою очередь, инициируют процессы врожденной и, косвенно, адаптивной иммунной системы, индуцируя ряд цитокинов, включая IFN.РНК-хеликазы, индуцируемый ретиноевой кислотой, ген I (RIG-I или DDX58) и ген 5, связанный с дифференцировкой меланомы (MDA5 или IFIh2), являются первичными сенсорами РНК в цитозоле, тогда как цитозольная GAMP-синтаза (cGAS) отвечает за обнаружение ДНК в цитоплазме, где она не должна существовать вне митоза. Различные TLR на поверхности клетки и в эндосомах обнаруживают вирусные или бактериальные PAMP (LPS по TLR4, дцРНК по TLR3, оцРНК по TLR7 и TLR8 и неметилированная ДНК CpG по TLR9) (1, 17). Сигнальные каскады от всех этих PRR в конечном итоге сходятся на основных регуляторах экспрессии IFN, семействе факторов транскрипции IFN-регуляторного фактора (IRF), из которых IRF3 и IRF7 являются кардинальными (1).Несколько других путей PRR сходятся на один шаг выше IRF. TANK-связывающая киназа 1 (TBK1) и IκB киназа-ε (IKKε) образуют комплекс, который непосредственно фосфорилирует IRF3 и IRF7. TBK1 и IKKε активируются обоими цитозольными РНК-сенсорами (RIG-I и MDA5), цитозольным ДНК-сенсорным cGAS, эндосомным dsRNA сенсором TLR3 и LPS-детектирующим TLR4. RIG-I и MDA5 зависят от митохондриального антивирусного сигнального белка (MAVS) для активации IRF3 через TBK1 / IKKε, тогда как молекулярные сообщения от cGAS, TLR3 и TLR4 достигают TBK1 / IKKε и, в конечном итоге, IRF3 независимо от MAVS.cGAS генерирует циклическую динуклеотидную сигнальную молекулу, называемую циклическим ди-GMP-AMP (cGAMP), в ответ на стимуляцию цитозольной ДНК. cGAMP распознается стимулятором генов IFN (STING или TMEM173). В эндоплазматическом ретикулуме STING рекрутирует TBK1 и IRF3 для фосфорилирования IRF3 с помощью TBK1 аналогично тому, как это наблюдается для рекрутирования этих белков на митохондриальную мембрану с помощью MAVS (18). В конечном итоге эти различные способы фосфорилирования IRF приводят к продукции IFN-I и активации иммунной системы через IFNAR.
Связывание цитокинов с IFNAR запускает димеризацию двух субъединиц рецептора, IFNAR1 и IFNAR2. Когда рецепторы оказываются в непосредственной близости, киназы Janus JAK1 и TYK2 трансфосфорилируют друг друга, а также участки субъединиц рецептора, в которых белки STAT связываются с комплексом. Затем JAK фосфорилируют STAT1 и STAT2, которые затем димеризуются и связываются с IRF9 с образованием комплекса фосфорилированных факторов транскрипции, стимулированного IFN гена фактора 3 (ISGF3). ISGF3 перемещается в ядро, где он связывается с IFN-стимулированным ответным элементом (консенсусная последовательность 5′-TTTCNNTTTC-3 ‘) сайтами энхансера, связанными с промоторами более чем 380 генов-мишеней, известных как IFN-стимулированные гены (ISG) (19 ).Белки, кодируемые этими генами, противодействуют репликации вирусов и инициируют воспалительные процессы (1, 17, 20). Однако функции IFN-I выходят за рамки устойчивости к патогенам.
С постепенным выяснением противовирусной функции IFN-I и молекулярных механизмов быстрой индукции в ответ на острую инфекцию, также появилась важная роль почти неопределяемых исходных уровней IFN-I. Несмотря на небольшое количество задействованных цитокинов, тоническая экспрессия IFN-I оказывает заметное влияние на несколько ключевых онтогенетических и иммунных процессов, начиная от поддержания компартмента гемопоэтических стволовых клеток и заканчивая функцией иммунных клеток.Считается, что постоянно продуцируемый в здоровой ткани IFN действует путем поддержания стехиометрии сигнальных белков, которые сами являются ISG (например, STAT1) в ответ на широкую сеть цитокинов (21-24). Соотношение этих промежуточных продуктов может определять, как клетка реагирует на конкретный цитокин или инфекционное поражение (22). Например, низкие уровни STAT3 приводят к ответу IL-6, который больше напоминает ответ IFN-II (25), и усиливает противовирусную активность, запускаемую IFN-I, поскольку STAT1 предпочтительно фосфорилируется в обоих контекстах (26).Кроме того, стволовые клетки конститутивно экспрессируют специфичную для клеточного типа субпопуляцию ISG, хотя они не реагируют на стимуляцию IFN. Эта внутренняя экспрессия ISG защищает от вирусной инфекции, но постепенно теряется во время терминальной дифференцировки, поскольку чувствительность к цитокинам IFN приобретается обратно (27). Есть несколько описанных примеров IFN-I-независимой индукции ISG, включая прямое связывание IRF со многими промоторами ISG (17, 20) и нефосфорилированную форму ISGF3, которая способствует экспрессии выбранных ISG спустя долгое время после прекращения активности рецепторов, запускаемых цитокинами. (28–30).Следовательно, появление IFN-I-независимой экспрессии ISG в таком масштабе дополнительно подчеркивает важность базовой активности ISG в различных контекстах и поднимает новые вопросы о механизмах, регулирующих систему IFN.
К сожалению, тонизирующая активность IFN редко обсуждается в литературе, что является жертвой ее собственной тонкости и, вероятно, технических ограничений ее изучения в прошлом. Понятно, что нас привлекает спектакль, вызванный IFN, который следует за инфекцией, в котором происходят значительные изменения в экспрессии генов и клеточной активности, а система может быть упрощена в контексте врожденного иммунитета.Наша зависимость от определения IFN-I на основе сыворотки без возможности измерить IFN-I в тканях, где большее количество цитокинов может выделяться чаще, оказалась серьезным препятствием для его изучения. Однако улучшение нашей способности обнаруживать исчезающе малые количества цитокинов открыло новое окно. Недавно сообщалось, что цифровой ELISA с одиночным молекулярным массивом способен обнаруживать аттомолярные концентрации (10 −18 моль / л) IFN-α у здоровых людей, вирусных инфекций и сложных или моногенных интерферонопатий (31).В отсутствие этой чувствительности определение активности IFN основывалось на усилении сигнала в форме мРНК от ISG, чтобы служить прокси для обнаружения цитокинов (32, 33). В любом случае, различные функции тонической экспрессии при бесконечно малых количествах IFN подчеркивают не только важность, но и чувствительность системы, расположенной ниже цитокина, и демонстрируют, как даже незначительное нарушение регуляции может иметь существенные последствия.
Верхний предел: интерферонопатии I типа
Системная красная волчанка была первым заболеванием, в патогенезе которого были вовлечены неадекватно высокие уровни активности IFN-I (4).Интерферонопатии типа I составляют растущую группу со многими генетическими факторами, связанными с дефицитом процессинга нуклеиновых кислот или детектирования, ведущего к гиперактивной продукции IFN-I. Проблема нарушения регуляции IFN была впервые поднята д-ром И. Грессером в Институте научных исследований рака в Вильжюифе, Франция. В серии экспериментов, охватывающих середину 1970-х — начало 1980-х, он и его сотрудники продемонстрировали влияние IFN на смертность, рост и повреждение тканей в зависимости от стадии развития.Его дальновидное мышление предполагало, что вирус-индуцированное заболевание может на самом деле в некоторой степени быть результатом IFN-опосредованного воспаления, а не цитопатического эффекта самого вируса (13, 14), этот принцип был подтвержден несколькими исследованиями, которые показали, что IFN-связанное воспаление является важным фактором патологии во время инфекции (34–36).
Между тем его работа на мышах с разной восприимчивостью к гриппу в контексте экзогенного IFN помогла установить генетическую этиологию, лежащую в основе переменной восприимчивости к инфекции между людьми и ее подчинение относительной чувствительности к IFN (37).
Прототипическим примером нарушения регуляции IFN является синдром Айкарди – Гутьера (AGS), менделевское системное аутовоспалительное состояние, характеризующееся высоким уровнем активности IFN в отсутствие инфекции (38, 39). Это условие имеет классические и неклассические формы. Помимо этого различия, классический фенотип подразделяется на формы с ранним и поздним началом, хотя обе обычно проявляются в течение первого года жизни. В редких случаях раннего начала осложнения отмечались при рождении, что указывает на то, что прогрессирование заболевания может начаться в утробе матери.У пациентов наблюдается неврологическая дисфункция в виде прогрессирующей микроцефалии, спастичности и психомоторной задержки, которые могут сопровождаться внутричерепной кальцификацией, изменениями белого вещества и аномально высоким количеством лейкоцитов в спинномозговой жидкости. Примерно 35% этих людей умирают в раннем детстве. Это проявление AGS очень похоже на последствия, наблюдаемые у младенцев, страдающих трансплацентарной инфекцией, отсюда и различие как псевдо-TORCH-синдром. Чаще всего начало AGS происходит в возрасте нескольких месяцев.Симптомы похожи на симптомы раннего начала, но потенциально менее серьезны. Любопытно, что движущим фактором, определяющим раннее или позднее начало, является генетическая причина (38, 40). AGS имеет семь генетических этиологий: TREX1 (41), RNASEh3A, RNASEh3B, RNASEh3C (вместе кодируют ферментный комплекс РНКазы h3) (42), SAMHD1 (43), ADAR1 (44) и IFIh2 (45), все из которых участвуют в метаболизме или обнаружении нуклеиновых кислот. Мутация потери функции в процессорах РНК может вызвать накопление нуклеиновой кислоты, тогда как усиление функции в PRR может создать гиперчувствительность к здоровым уровням нуклеиновой кислоты.Раннее начало связано с мутациями в TREX1, RNASEh3A и RNASEh3C , тогда как более частое и медленное прогрессирование заболевания связано с мутациями в RNASEh3B, SAMHD1 и ADAR1 (38, 40).
Неклассическая форма AGS характеризуется полным или частичным отсутствием фенотипа заболевания, несмотря на наличие мутаций в генах, которые, как известно, связаны с AGS. Даже в семьях, затронутых AGS, переменная пенетрантность приводит к дискордантному прогрессированию заболевания (40, 45), и это отражает более широкую картину в области интерферонопатии I типа.Другими словами, поле не охарактеризовано факторами, которые способствуют заболеванию, за исключением наличия связанных мутаций. Внутри AGS синдромальный фенотип расширился за счет сообщений о неклассических, менее типичных проявлениях у людей с мутациями в различных генах AGS (46–51), тогда как другие генетические факторы интерферонопатий типа I были приписаны мутациям в небольшом количестве генов. разбросаны по регулятивной батарее IFN-I. De novo гетерозиготные мутации с усилением функции в TMEM173 , который кодирует адаптерный белок STING, который получает cGAMP от cGAS в цитозольном пути определения ДНК, были связаны с STING-ассоциированной васкулопатией с началом в младенчестве, аутовоспалительной васкулопатией язвенными поражениями акральной кожи, от которых у многих пациентов развиваются интерстициальные заболевания легких и лихорадка (4, 52).Другие мутации, связанные с интерферонопатиями типа I, включая редкие случаи менделевской системной красной волчанки, были зарегистрированы в гене ACP5 (который кодирует устойчивую к тартрату кислую фосфатазу 5 типа и приводит к спондилоэнхондродисплазии с иммунной дисрегуляцией) (53) и ДНКазы ( DNASE1 или DNASE1L3 ), которые ответственны за деградацию внеклеточной ДНК (4, 54–56).
Обнаружение людей с двуаллельными мутациями потери экспрессии в ISG15 и выяснение механизма, лежащего в основе ассоциированных симптомов, подобных интерферонопатии I типа, явились значительным прорывом в этой области.Хотя первоначально это было задокументировано в 2012 году в исследовании, посвященном этим людям из-за их повышенной восприимчивости к микобактериальной инфекции из-за связанного с ними дефекта выработки IFN-II (57, 58), причина ауто-воспаления у этих пациентов была установлена только в 2015 году. (59). До этого момента все ранее идентифицированные причины сверхактивации IFN проистекали из дефектов в оборудовании, предшествующем производству цитокинов, и все же здесь был сценарий, в котором потеря ISG, нижележащего компонента системы, каким-то образом приводила к высоким уровням IFN-I активность.Оказалось, что одна из функций ISG15 заключается в стабилизации мощного негативного регулятора IFN-сигнальной убиквитин-специфической пептидазы 18 (USP18) (59–61). Таким образом, потеря ISG15 приводит к увеличению оборота USP18, что эффективно снижает концентрацию негативного регулятора в клетке. Более низкие концентрации USP18 приводят к менее эффективной петле отрицательной обратной связи в передаче сигналов IFN. Неудивительно, что нарушение способности отключать передачу сигналов IFN-I вызывает фенотип, аналогичный, но менее тяжелый, чем у классического AGS: кальцификации базальных ганглиев и повышенная сигнатура IFN-I в крови (59).Из выявленных на сегодняшний день пациентов с нулевым ISG15 подавляющее большинство живут относительно нормальной жизнью в возрасте около двадцати лет. Таким образом, потеря ISG15 совместима с жизнью.
К сожалению, полный дефицит USP18 приводит к летальному исходу. В отличие от дефицита ISG15, индивидуумы с нулевым USP18 не могут негативно регулировать передачу сигналов IFN-I ниже рецептора, и в результате болезнь быстро прогрессирует. Все пять пациентов с двуаллельными мутациями потери экспрессии в гене USP18 развили псевдо-TORCH-подобный фенотип, аналогичный фенотипу тяжелого AGS, с врожденным иммунным воспалением, кальцификациями мозга и полимикрогирией, и умерли в течение 22 дней после смерти. рождение (62).
Связью между этими двумя расстройствами является отсутствие USP18. Хотя относительные количества USP18 определяют серьезность клинического исхода, более низкие уровни USP18 в обоих состояниях по сравнению с таковыми у здоровых людей — это то, что позволяет IFN-опосредованному ауто-воспалению, поддерживаемому устойчивой экспрессией ISG (59, 63). Тем не менее, остается неясным, как потеря отрицательного регулятора, эффективно (нулевой ISG15) или фактически (нулевой USP18), может приводить к повышенным уровням цитокинов IFN-I в крови.Рабочий ответ имеет несколько уровней сложности из-за несколько замкнутой природы сигнальных каскадов. Прототипный биологический сигнальный каскад индуцирует экспрессию своего собственного регуляторного механизма для усиления и / или ослабления величины своего эффекта. В этом смысле передача сигналов IFN ничем не отличается. Некоторые из ISG, устойчиво экспрессируемых у лиц с дефицитом ISG15 и USP18, кодируют PRR и промежуточные продукты передачи сигналов, которые активируют и увеличивают как количество продуцируемого IFN-I, так и чувствительность ответа.Эти механизмы вместе создают состояние гиперреактивности / гиперчувствительности как к PAMP, так и к IFN-I внутри клетки, но они все еще не объясняют, как срабатывает переключатель активации. В AGS дефекты процессинга нуклеиновой кислоты приводят к обилию РНК в цитоплазме, которая может или не может нуждаться в повреждении для обнаружения (необходимость такого повреждения — вопрос, выходящий за рамки этого обзора). Поскольку накопление поврежденных нуклеиновых кислот вряд ли будет стимулом в случае воспаления, связанного с ISG15 и USP18, поскольку у этих людей нет известной проблемы с процессингом нуклеиновых кислот, состояние гиперчувствительности может способствовать активации IFN в ответ на то, что Обычно уровни PAMP у здорового человека несущественны.Разумно предположить, что мы ежедневно подвергаемся воздействию инфекционных и иммуностимулирующих агентов в концентрациях, безвредных для здоровых людей. Однако у людей с низким уровнем USP18 или без него, которые являются сверхчувствительными к стимуляции PAMP, эти события становятся топливом для самовоспроизводящейся петли активации IFN-I, хотя это еще предстоит доказать экспериментально. Аналогичный аргумент можно также привести в пользу гомеостатических уровней поврежденных нуклеиновых кислот как фактора стойкого воспаления путем замены PAMP на нежелательные продукты нуклеиновых кислот в том же контексте.
Потери функции ISG15 и USP18 также вызывают вопросы об относительной простоте индукции ISG. В этой модели хроматиновый ландшафт вместе с количеством и качеством связывания ISGF3 с промотором определенного ISG может влиять на относительную готовность этого гена к индуцированию IFN-I. Эта теория может объяснить, почему только несколько избранных из ∼400 канонических ISG активируются в дермальных фибробластах, полученных от пациентов, ISG15-нулевые дермальные фибробласты через 36 часов после стимуляции в течение 12 часов экзогенным IFN-α2b по сравнению с клетками WT, обработанными таким же образом (59 ).Собственно, дефицит ISG15 — далеко не единственный пример этого паттерна экспрессии ISG. Относительная чувствительность к стимуляции IFN-I, вероятно, относится к широкому спектру явлений, связанных с регуляцией ISG. Это, вероятно, может варьироваться от тонической активности IFN до описанной выше внутренней и специфической для клеточного типа экспрессии ISG в стволовых клетках, несмотря на их рефрактерный ответ на стимуляцию IFN-I (27), до подмножества канонических ISG, которые индуцируются нефосфорилированными форма ISGF3 (28–30).
Исследование дефицита ISG15 in vitro начало определять нижний предел IFN-I-опосредованного воспаления, эффективного против вирусной инфекции.Немногочисленные персистирующие ISG, описанные выше, экспрессируются только на уровне 1% от пикового уровня, но на порядки лучше при контроле вирусной инфекции, чем в контрольной группе WT, обработанной аналогичным образом, в которой уровни ISG практически вернулись к исходному уровню (63). Этот поздний момент времени после воздействия IFN резюмирует широту и величину воспаления, которое естественным образом возникает у этих индивидуумов in vivo, а повышенная способность ограничивать репликацию вируса, наблюдаемая in vitro, убедительно указывает на фенотип усиления функции.Другими словами, стойкое воспаление, вызванное низким уровнем IFN-I, которое проявляется у лиц с нулевым уровнем ISG15, усиливает их способность бороться с острой вирусной инфекцией и, если его использовать, может оказать разоблачительное влияние на разработку новых противовирусных методов лечения.
Нижний предел: нечувствительность к IFN-I
Причуды в системе, такие как тоническая экспрессия IFN, IFN-независимая экспрессия ISG и встроенная избыточность в трех семействах IFN, которые мы кратко обсудим ниже, позволяют IFN -I система должна функционировать в достаточной степени при уровнях активности, намного более низких, чем те, которые наблюдаются у здорового человека во время острой инфекции.Они также являются механизмами, которые, скорее всего, компенсируют дефекты в аппарате ответа IFN-I.
Принимая во внимание все, что известно о действенности IFN-I, эффективности, с которой он ограничивает острую вирусную инфекцию, а также уклонении и антагонизме со стороны вирусов, представляется вероятным, что неспособность реагировать на сигналы IFN-I может угрожать иммунной системе. система. Тем не менее, люди без экспрессии STAT1 , STAT2 и IFNAR2 существуют, и последствия этих недостатков не всегда столь катастрофичны, как ожидалось.Это не означает, что эти люди здоровы, а скорее, что генетика человека может помочь нам понять, как система IFN уравновешивает себя во всех трех семьях, используя вышеупомянутые причуды.
Потеря IFNAR фактически эквивалентна полной потере сигнализации IFN-I. В одном примере два брата и сестры с гомозиготной усеченной мутацией в IFNAR2 не проявили явной предрасположенности к обычным, естественным респираторным вирусным инфекциям в течение первого года жизни.К сожалению, у старшего брата и сестры после вакцинации против кори, эпидемического паротита и краснухи (MMR) в возрасте 13 месяцев развился смертельный энцефалит, но его младший брат не был вакцинирован и не пострадал, когда эти случаи были опубликованы (64).
Самым простым объяснением здесь является то, что IFN-III восполняет слабость, оставленную неработающим IFNAR, в той степени, в которой он защищает обоих братьев и сестер от естественных инфекций, но не от MMR в случае вакцинированного пробанда. ИФН-III, также известный как ИФН-λ, в основном изучается на мышах, но он передает сигналы по тому же пути, что и ИФН-I, но использует другой рецептор и индуцирует многие из тех же генов, что и ИФН-I.Как и его аналоги типа I, IFN-λ также оказывает иммуномодулирующее действие на адаптивную иммунную систему в качестве промотора дифференцировки макрофагов и дендритных клеток (2). В частности, эпителиальные клетки являются основными клетками, которые реагируют на IFN-λ, что имеет эволюционный смысл, поскольку большинство инфекций начинается с эпителия. Новые данные на мышах показали, что IFN-λ фактически секретируется раньше цитокинов типа I во время инфекции гриппа и что индуцированная кассета IFN-λ-стимулированных генов ограничивает инфекцию, не вызывая воспаления (65).Это мнение было подтверждено недавним исследованием человека, у которого наблюдается дигенный гомозиготный дефицит IFNAR1 (потеря стоп-кодона привела к расширенному белку с гипоморфным ответом на цитокин) и рецептору IFN-γ (ограниченная экспрессия и отсутствие передачи сигналов). и, как результат, были выявлены распространенные микобактерии, бактериемия Streptococcus viridans, и исключительно высокая цитомегаловирусная виремия. Примечательно, что в отличие от родственника IFNAR2 с потерей функции, описанного выше (64), этот пациент не страдает от осложнений после вакцинации MMR (66), вероятно, потому, что чувствительность пациента к IFN-I, хотя и гипоморфна, достаточна для контроля инфекции и / или демонстрирует компенсаторную способность IFN-λ.
В отсутствие STAT2 ни IFN-I, ни IFN-λ не могут функционировать по своим каноническим путям, но, как и при дефиците IFNAR2, чувствительность к вирусам остается весьма непостоянной. В отчетах постоянно описываются ситуации, в которых у одного или нескольких пострадавших членов группы развиваются опасные для жизни смертельные инфекции, а у других — нет. Гомозиготная мутация сплайсинга в интроне 4, которая приводит к полному дефициту STAT2, была обнаружена у пяти членов одной семьи.Один умер от неконтролируемой вирусной инфекции в младенчестве, и хотя все трое выживших детей были госпитализированы с тяжелыми инфекциями, все они сейчас, как и пораженные взрослые в этом роде, в целом здоровы с нормальным развитием (67). В другом случае два брата и сестры пережили лихорадочное заболевание, вызванное вакцинацией MMR, но только у одного развились тяжелые неврологические нарушения (68). Таким образом, отсутствие STAT2 может иметь катастрофические последствия для некоторых людей, но очевидное нормальное функционирование, наблюдаемое у других, указывает на избыточность врожденного иммунитета, возможно, из-за перекрытия транскрипционных мишеней в семьях IFN.Хорошо известно, что некоторые ISG имеют IFN-γ-активирующие сайты (GAS) в своих промоторах и, следовательно, беспорядочно включаются любым сигналом (17, 69). Эти элементы GAS задействованы фактором активации IFN-γ (GAF), который состоит из гомодимера STAT1, для активации транскрипции в ответ на IFN-II и, в меньшей степени, на IFN-I (70–72). Хотя существует значительно меньшее совпадение целевых показателей между IFN-I и IFN-II, чем между IFN-I и IFN-III (λ) (65, 73, 74), наблюдение, что не все люди с дефицитом STAT2 страдают от серьезно нарушенного вирусного иммунитета, предполагает эта избыточность в системе может обеспечить достаточную защиту от острой инфекции.Этот вывод подтверждается работой нашей группы, которая показала улучшенную устойчивость к вирусам только небольшой частью канонических ISG при низких уровнях экспрессии (1% от предполагаемого пика) (59, 63). Между тем, тенденция к ранней пенетрантности указывает на то, что время воздействия вируса является важным фактором, определяющим исход болезни.
Дефицит двуаллельного STAT1 резко контрастирует, показывая, что невозможно компенсировать полное отсутствие IFN-опосредованной активности. Другими словами, дефицит STAT1 является исключением, подтверждающим правило: IFN-I не нужен, если IFN-II и IFN-λ могут обеспечивать достаточную противовирусную активность.Пораженные люди обладают почти нулевой способностью реагировать на любой из трех семейств цитокинов IFN посредством классических сигнальных путей, и эти люди эффективно определяют нижний предел выживаемости, опосредованной IFN. В результате фенотип дефицита STAT1 является наиболее серьезным из трех известных генетических дефектов у людей, которые нарушают ответ IFN. Было показано, что гомозиготные мутации с потерей функции STAT1 вызывают менделевскую восприимчивость к микобактериальным заболеваниям и неадекватный контроль вирусной инфекции у двух неродственных младенцев (75).
Какими бы неудачными ни были эти случаи, они недвусмысленно демонстрируют, что полная потеря всех трех сигналов IFN приводит к критическому нарушению врожденного иммунитета и несовместимости с жизнью. Однако аутосомно-доминантные дефекты STAT1 (V266I, K201N, L706S, Q463H, E320Q) подтверждают мнение о том, что для относительно здоровой жизни требуются очень низкие уровни активности IFN. У этих людей также наблюдается менделевская восприимчивость к микобактериальным заболеваниям из-за пониженной активности IFN-II, но они обычно не умирают от вирусной инфекции из-за относительно неизменного ответа IFN-I (76–79).Это предполагает, что количество STAT1, необходимое для эффективной IFN-I-опосредованной индукции ISG, меньше, чем то, которое требуется для индукции ISG IFN-II с этими генетическими вариациями. Кроме того, мРНК из небольшого числа ISGs и взаимодействий элементов pSTAT3-GAS была обнаружена в трансформированных вирусом Эпштейна-Барра B-клетках, происходящих от обоих STAT1-нулевых младенцев, обсуждаемых выше (75). Этой активности ISG было недостаточно, чтобы поддерживать их жизнь, но эти результаты снова указывают на потенциальную роль, которую неканоническая регуляция ISG может играть в менее дефектных системах IFN.
Изучение его влияния на инфекционные заболевания
Ключевой игрок в формировании клеточного иммунитета, IFN-γ способен управлять многочисленными защитными функциями для усиления иммунных ответов при инфекциях и раках. Он может проявлять свои иммуномодулирующие эффекты, усиливая процессинг и презентацию антигена, увеличивая трафик лейкоцитов, вызывая антивирусное состояние, усиливая антимикробные функции и влияя на клеточную пролиферацию и апоптоз. Сложное взаимодействие между активностью иммунных клеток и IFN-γ посредством скоординированной интеграции сигналов от других путей с участием цитокинов и рецепторов распознавания образов (PRR), таких как интерлейкин (IL) -4, TNF-α, липополисахарид (LPS), интерфероны типа I (IFNS) и т. Д.приводит к запуску каскада провоспалительных реакций. Данные микроматрицы раскрыли многочисленные гены, на регуляцию транскрипции которых влияет IFN-γ. Следовательно, клетки, стимулированные IFN-γ, демонстрируют измененную экспрессию многих таких генов-мишеней, которые опосредуют его последующие эффекторные функции. Важность IFN-γ дополнительно подтверждается тем фактом, что у мышей с нарушениями в гене IFN-γ или его рецепторах развивается крайняя предрасположенность к инфекционным заболеваниям и они быстро умирают.В этом обзоре мы пытаемся выяснить биологические функции и физиологическое значение этого универсального цитокина. Также обсуждаются функциональные последствия его биологической активности при некоторых инфекционных заболеваниях и аутоиммунных патологиях. В качестве ответной стратегии многие вирулентные патогенные виды разработали способы препятствовать иммунной защите, обеспечиваемой IFN-γ. Таким образом, опосредованные IFN-γ взаимодействия хозяин-патоген имеют решающее значение для нашего понимания механизмов заболевания, и эти аспекты также демонстрируют огромное терапевтическое значение для устранения различных инфекций и аутоиммунных состояний.
Ссылки
1 Schroder K, Hertzog PJ, Ravasi T, Hume DA. Интерферон-γ: обзор сигналов, механизмов и функций. Журнал биологии лейкоцитов 2004; 75: 163-89. Искать в Google Scholar
2 Rothfuchs AG, Trumstedt C, Wigzell H, Rottenberg ME. Индуцированный внутриклеточной бактериальной инфекцией IFN-γ критически, но не только зависит от толл-подобного рецептора, 4-миелоидного фактора дифференцировки 88-IFN-αβ-STAT1. Журнал иммунологии 2004; 172: 6345-53. Искать в Google Scholar
3 Наглак Е.К., Моррисон С.Г., Моррисон Р.П.Гамма-интерферон необходим для оптимального опосредованного антителами иммунитета против инфекции генитального хламидиоза. Инфекция и иммунитет 2016; 84: 3232-42. Искать в Google Scholar
4 Green AM, DiFazio R, Flynn JL. IFN-γ из Т-лимфоцитов CD4 необходим для выживания хозяина и усиливает функцию Т-лимфоцитов CD8 во время инфекции Mycobacterium tuberculosis. Журнал иммунологии 2013; 190: 270-7. Искать в Google Scholar
5 Baird NL, Bowlin JL, Hotz TJ, Cohrs RJ, Gilden D. Гамма-интерферон продлевает выживаемость инфицированных вирусом ветряной оспы человеческих нейронов in vitro.Журнал вирусологии 2015; 89: 7425-7. Искать в Google Scholar
6 Kokordelis P, Krämer B, Körner C, et al. Эффективное опосредованное интерфероном гамма ингибирование репликации вируса гепатита С естественными клетками-киллерами связано со спонтанным избавлением от острого гепатита С у пациентов с положительным результатом вируса иммунодефицита человека. Гепатология 2014; 59: 814-27. Искать в Google Scholar
7 Beekhuizen H, van de Gevel JS. Гамма-интерферон придает устойчивость к инфекции Staphylococcus aureus в эндотелиальных клетках сосудов человека за счет совместной провоспалительной и усиленной внутренней антибактериальной активности.Инфекция и иммунитет 2007; 75: 5615-26. Искать в Google Scholar
8 Koo GC, Gan Y-H. Врожденный гамма-ответ интерферона мышей BALB / c и C57BL / 6 на инфекцию Burkholderia pseudomallei in vitro. BMC Immunology 2006; 7:19. Искать в Google Scholar
9 Miller CH, Maher SG, Young HA. Клиническое применение интерферона-γ. Анналы Нью-Йоркской академии наук 2009; 1182: 69-79. Искать в Google Scholar
10 Belkaid Y, Rouse BT. Природные регуляторные Т-клетки при инфекционных заболеваниях.Иммунология природы 2005; 6: 353. Искать в Google Scholar
11 Frucht DM, Fukao T, Bogdan C, Schindler H, O’Shea JJ, Koyasu S. Продукция IFN-гамма антигенпрезентирующими клетками: возникают механизмы. Trends Immunol 2001; 22: 556-60. Искать в Google Scholar
12 Boehm U, Guethlein L, Klamp T, et al. Два семейства GTPases доминируют в сложном клеточном ответе на IFN-γ. Журнал иммунологии 1998; 161: 6715-23. Искать в Google Scholar
13 Bach EA, Aguet M, Schreiber RD.Рецептор IFNγ: парадигма передачи сигналов рецептора цитокина. Ежегодный обзор иммунологии 1997; 15: 563-91. Искать в Google Scholar
14 Ramana CV, Gil MP, Schreiber RD, Stark GR. Stat1-зависимые и независимые пути в IFN-γ-зависимой передаче сигналов. Тенденции в иммунологии 2002; 23: 96-101. Искать в Google Scholar
15 Lighvani AA, Frucht DM, Jankovic D, et al. T-bet быстро индуцируется интерфероном-γ в лимфоидных и миелоидных клетках. Труды Национальной академии наук 2001; 98: 15137-42.Искать в Google Scholar
16 Djuretic IM, Levanon D, Negreanu V, Groner Y, Rao A, Ansel KM. Факторы транскрипции T-bet и Runx3 взаимодействуют, чтобы активировать Ifng и заглушить Il4 в Т-хелперных клетках 1 типа. Природная иммунология 2007; 8: 145. Искать в Google Scholar
17 Afkarian M, Sedy JR, Yang J, et al. T-bet представляет собой STAT1-индуцированный регулятор экспрессии IL-12R в наивных CD4 + Т-клетках. Природа иммунологии 2002; 3: 549. Искать в Google Scholar
18 Flannagan RS, Cosío G, Grinstein S.Антимикробные механизмы фагоцитов и стратегии уклонения от бактерий. Обзоры природы Microbiology 2009; 7: 355. Искать в Google Scholar
19 Li P, Du Q, Cao Z, et al. Интерферон-гамма индуцирует аутофагию с ингибированием роста и гибелью клеток в клетках гепатоцеллюлярной карциномы человека (ГЦК) посредством интерферон-регулирующего фактора-1 (IRF-1). Письма о раке 2012; 314: 213-22. Искать в Google Scholar
20 Сингх С.Б., Дэвис А.С., Тейлор Г.А., Деретик В. Человеческий IRGM вызывает аутофагию для уничтожения внутриклеточных микобактерий.Наука 2006; 313: 1438-41. Искать в Google Scholar
21 MacMicking JD. Интерферон-индуцируемые эффекторные механизмы клеточно-автономного иммунитета. Обзоры природы Immunology 2012; 12: 367. Искать в Google Scholar
22 MacMicking JD, Taylor GA, McKinney JD. Иммунный контроль туберкулеза с помощью IFN-γ-индуцибельного LRG-47. Наука 2003; 302: 654-9. Искать в Google Scholar
23 Kim BH, Shenoy AR, Kumar P, Das R, Tiwari S, MacMicking JD. Семейство IFN-γ-индуцибельных ГТФаз 65 кДа защищает от бактериальной инфекции.Наука 2011; 332: 717-21. Искать в Google Scholar
24 Schnoor M, Betanzos A, Weber D, Parkos C. Гуанилат-связывающий белок-1 экспрессируется в плотных контактах эпителиальных клеток кишечника в ответ на интерферон-γ и регулирует барьерную функцию посредством воздействия на апоптоз. Иммунология слизистой оболочки 2009; 2: 33-42. Искать в Google Scholar
25 Murray PJ. Ауксотрофия аминокислот как узлы иммунологического контроля. Природа иммунологии 2016; 17: 132. Искать в Google Scholar
26 Day PM, Thompson CD, Lowy DR, Schiller JT.Интерферон-гамма предотвращает инфекционное проникновение вируса папилломы человека 16 через L2-зависимый механизм. Журнал вирусологии 2017; 91: e00168-17. Искать в Google Scholar
27 Feeley EM, Sims JS, John SP, et al. IFITM3 подавляет инфицирование вирусом гриппа А, предотвращая проникновение в цитозоль. Патогены PLoS 2011; 7: e1002337. Искать в Google Scholar
28 Хатакеяма С. Белки семейства TRIM: роль в аутофагии, иммунитете и канцерогенезе. Тенденции в биохимических науках, 2017 г. Поиск в Google Scholar
29 Биеринг С.Б., Чой Дж., Хальстром Р.А. и др.Комплексы репликации вирусов нацелены на индуцируемые LC3 интерферон-индуцируемые GTPases. Cell Host & Microbe 2017; 22: 74-85.e7. Искать в Google Scholar
30 Dotson D, Woodruff EA, Villalta F, Dong X. Филамин А участвует в опосредованном ВИЧ-1 Vpu уклонении от ограничения хозяина, модулируя экспрессию тетерина. Журнал биологической химии 2016; 291: 4236-46. Искать в Google Scholar
31 Fabri M, Stenger S, Shin D-M, et al. Витамин D необходим для опосредованной IFN-γ антимикробной активности макрофагов человека.Наука трансляционная медицина 2011; 3: 104ра2-ра2. Искать в Google Scholar
32 Jabado N, Jankowski A, Dougaparsad S, Picard V, Grinstein S, Gros P. Естественная устойчивость к внутриклеточным инфекциям. Журнал экспериментальной медицины 2000; 192: 1237-48. Искать в Google Scholar
33 White C, Lee J, Kambe T, Fritsche K, Petris MJ. Роль АТФ7А-транспортирующей медь АТФазы в бактерицидной активности макрофагов. Журнал биологической химии 2009; 284: 33949-56. Искать в Google Scholar
34 Deriu E, Liu JZ, Raffatellu M.13 Сальмонелла и воинство в битве за железо. Ответ на стресс у патогенных бактерий 2011; 19: 283. Искать в Google Scholar
35 Flynn JL, Chan J, Triebold KJ, Dalton DK, Stewart TA, Bloom BR. Существенная роль интерферона гамма в устойчивости к инфекции Mycobacterium tuberculosis. Журнал экспериментальной медицины 1993; 178: 2249-54. Искать в Google Scholar
36 Флинн Дж. Л., Чан Дж. Иммунология туберкулеза. Ежегодный обзор иммунологии 2001; 19: 93-129. Искать в Google Scholar
37 Altare F, Jouanguy E, Lamhamedi S, Doffinger R, Fischer A, Casanova J-L.Менделирующая предрасположенность человека к микобактериальной инфекции. Текущее мнение в иммунологии 1998; 10: 413-7. Искать в Google Scholar
38 Cheallaigh CN, Sheedy FJ, Harris J, et al. Распространенный вариант адаптера Mal регулирует передачу сигналов гамма-интерферона. Иммунитет 2016; 44: 368-79. Искать в Google Scholar
39 MacMicking JD. Клеточно-автономные эффекторные механизмы против Mycobacterium tuberculosis. Перспективы Колд-Спринг-Харбор в медицине, 2014; 4: a018507. Искать в Google Scholar
40 Herbst S, Schaible UE, Schneider BE.Макрофаги, активируемые интерфероном гамма, убивают микобактерии за счет апоптоза, вызванного оксидом азота. PloS one 2011; 6: e19105. Искать в Google Scholar
41 Shin DM, Yuk JM, Lee HM, et al. Липопротеин микобактерий активирует аутофагию посредством TLR2 / 1 / CD14 и функциональной передачи сигналов рецептора витамина D. Клеточная микробиология 2010; 12: 1648-65. Искать в Google Scholar
42 Yuk J-M, Yoshimori T, Jo E-K. Аутофагия и бактериальные инфекционные заболевания. Экспериментальная и молекулярная медицина 2012; 44: 99.Искать в Google Scholar
43 Harding CV, Boom WH. Регуляция презентации антигена Mycobacterium tuberculosis: роль Toll-подобных рецепторов. Обзоры природы Microbiology 2010; 8: 296. Искать в Google Scholar
44 Pennini ME, Pai RK, Schultz DC, Boom WH, Harding CV. Липопротеин Mycobacterium tuberculosis 19 кДа ингибирует IFN-γ-индуцированное ремоделирование хроматина MHC2TA с помощью передачи сигналов TLR2 и MAPK. Журнал иммунологии 2006; 176: 4323-30. Искать в Google Scholar
45 Pai RK, Pennini ME, Tobian AA, Canaday DH, Boom WH, Harding CV.Длительная передача сигналов толл-подобного рецептора Mycobacterium tuberculosis и ее липопротеин 19 килодальтон подавляют индуцированную гамма-интерфероном регуляцию выбранных генов в макрофагах. Инфекция и иммунитет 2004; 72: 6603-14. Искать в Google Scholar
46 Kincaid EZ, Ernst JD. Mycobacterium tuberculosis оказывает ген-селективное ингибирование транскрипционных ответов на IFN-гамма без подавления функции STAT1. Журнал иммунологии (Балтимор, Мэриленд: 1950) 2003; 171: 2042-9. Искать в Google Scholar
47 Olias P, Etheridge RD, Zhang Y, Holtzman MJ, Sibley LD.Эффектор токсоплазмы рекрутирует комплекс Mi-2 / NuRD для репрессии транскрипции STAT1 и блокирования IFN-γ-зависимой экспрессии гена. Клетка-хозяин и микроб 2016; 20: 72-82. Искать в Google Scholar
48 Alvarez GR, Zwilling BS, Lafuse WP. Ингибирование Mycobacterium avium передачи сигналов IFN-γ в макрофагах мыши: стимуляция toll-подобного рецептора 2 увеличивает экспрессию доминантно-отрицательного STAT1β за счет стабилизации мРНК. Журнал иммунологии 2003; 171: 6766-73. Искать в Google Scholar
49 Sugawara I, Yamada H, Mizuno S.Мыши с нокаутом STAT1 очень восприимчивы к легочной микобактериальной инфекции. Журнал экспериментальной медицины Тохоку 2004; 202: 41-50. Искать в Google Scholar
50 Bao S, Beagley KW, France MP, Shen J, Husband AJ. Интерферонгамма играет решающую роль в иммунитете кишечника против инфекции Salmonella typhimurium. Иммунология 2000; 99: 464-72. Искать в Google Scholar
51 Muotiala A, Makela PH. Роль IFN-гамма в инфицировании мышей Salmonella typhimurium. Микробный патогенез 1990; 8: 135-41.Искать в Google Scholar
52 Gilchrist JJ, MacLennan CA, Hill AV. Генетическая предрасположенность к инвазивной сальмонеллезной болезни. Обзоры природы Immunology 2015; 15: 452. Искать в Google Scholar
53 Jouanguy E, Döffinger R, Dupuis S, Pallier A, Altare F, Casanova J-L. IL-12 и IFN-γ в защите хозяина от микобактерий и сальмонелл у мышей и мужчин. Текущее мнение в иммунологии 1999; 11: 346-51. Искать в Google Scholar
54 Netea MG, Fantuzzi G, Kullberg BJ, et al. Нейтрализация IL-18 снижает накопление нейтрофилов в тканях и защищает мышей от смертельной эндотоксемии Escherichia coli и Salmonella typhimurium .Журнал иммунологии 2000; 164: 2644-9. Искать в Google Scholar
55 Rosenberger CM, Scott MG, Gold MR, Hancock RE, Finlay BB. Инфекция Salmonella typhimurium и стимуляция липополисахаридами вызывают аналогичные изменения в экспрессии генов макрофагов. Журнал иммунологии 2000; 164: 5894-904. Искать в Google Scholar
56 Gordon MA, Jack DL, Dockrell DH, Lee ME, Read RC. Гамма-интерферон усиливает интернализацию и раннее неокислительное уничтожение серовара Typhimurium Salmonella enterica человеческими макрофагами и изменяет цитокиновые ответы.Инфекция и иммунитет 2005; 73: 3445-52. Искать в Google Scholar
57 Nairz M, Fritsche G, Brunner P, Talasz H, Hantke K, Weiss G. Гамма-интерферон ограничивает доступность железа для интрамакрофага Salmonella typhimurium. Eur J Immunol 2008; 38: 1923-36. Искать в Google Scholar
58 Mitterstiller AM, Haschka D, Dichtl S, et al. Гемоксигеназа 1 контролирует ранний врожденный иммунный ответ макрофагов на инфекцию Salmonella Typhimurium. Cell Microbiol 2016; 18: 1374-89. Искать в Google Scholar
59 Brown DE, Nick HJ, McCoy MW, et al.Повышенная экспрессия ферропортина-1 и быстрая потеря железа в селезенке возникают при анемии, вызванной инфекцией Salmonella enterica Serovar Typhimurium у мышей. Инфекция и иммунитет 2015; 83: 2290-9. Искать в Google Scholar
60 Зеневич Л.А., Шен Х. Врожденные и адаптивные иммунные ответы на Listeria monocytogenes: краткий обзор. Микробы и инфекции 2007; 9: 1208-15. Искать в Google Scholar
61 Kernbauer E, Maier V, Stoiber D, et al. Условная абляция Stat1 показывает важность передачи сигналов интерферона для иммунитета к инфекции Listeria monocytogenes.Патогены PLoS 2012; 8: e1002763. Искать в Google Scholar
62 Reynders A, Yessaad N, Vu Manh TP, et al. Идентичность, регуляция и функция in vivo кишечных NKp46 + RORgammat + и NKp46 + RORgammat-лимфоидных клеток. Embo j 2011; 30: 2934-47. Искать в Google Scholar
63 Sonoda J, Laganière J, Mehl IR, et al. Ядерный рецептор ERRα и коактиватор PGC-1β являются эффекторами IFN-γ-индуцированной защиты хозяина. Гены и развитие 2007; 21: 1909-20. Искать в Google Scholar
64 Попов А., Абдулла З., Викенхаузер С. и др.Дендритные клетки, экспрессирующие индолеамин-2,3-диоксигеназу, образуют гнойные гранулемы после инфицирования Listeria monocytogenes. Журнал клинических исследований 2006; 116: 3160. Искать в Google Scholar
65 Ma F, Xu S, Liu X, et al. МикроРНК miR-29 контролирует врожденный и адаптивный иммунный ответ на внутриклеточную бактериальную инфекцию путем нацеливания на интерферон-гамма .. Nature Immunology 2011; 12: 861-9. Искать в Google Scholar
66 Ван М., Чжоу Ю., Чжу Ю. Подрыв функций макрофагов токсинами и эффекторами бактериальных белков.Актуальные вопросы молекулярной биологии 2017; 25: 61-80. Искать в Google Scholar
67 Lebreton A, Job V, Ragon M, et al. Структурная основа ингибирования репрессора хроматина BAHD1 бактериальным нуклеомодулином LntA. MBio 2014; 5: e00775-13. Искать в Google Scholar
68 Lebreton A, Lakisic G, Job V, et al. Бактериальный белок нацелен на комплекс хроматина BAHD1, чтобы стимулировать интерфероновый ответ типа III. Наука 2011; 331: 1319-21. Искать в Google Scholar
69 Rayamajhi M, Humann J, Kearney S, Hill KK, Lenz LL.Антагонистическое взаимодействие между интерферонами I и II типа и повышенная восприимчивость хозяина к бактериальным инфекциям. Вирулентность 2010; 1: 418-22. Искать в Google Scholar
70 Muller K, van Zandbergen G, Hansen B, et al. Хемокины, естественные клетки-киллеры и гранулоциты в раннем течении основной инфекции Leishmania у мышей. Медицинская микробиология и иммунология 2001; 190: 73-6. Искать в Google Scholar
71 душ Сантуш PL, de Oliveira FA, Santos MLB, et al. Тяжесть висцерального лейшманиоза коррелирует с повышенными уровнями сывороточного IL-6, IL-27 и sCD14.PLoS игнорирует тропические болезни 2016; 10: e0004375. Искать в Google Scholar
72 Singh N, Kumar R, Engwerda C, Sacks D, Nylen S, Sundar S. Альфа-нейтрализация фактора некроза опухоли не оказывает прямого влияния на бремя паразитов, но вызывает нарушение выработки IFN-γ клетками селезенки человека пациенты с висцеральным лейшманиозом. Цитокин 2016; 85: 184-90. Искать в Google Scholar
73 Carneiro MB, de Moura Lopes ME, Romano A, et al. Привлечение воспалительных моноцитов, опосредованное IFN-гамма, нейтрализует iNOS-зависимое уничтожение паразитов за счет увеличения пермиссивного резервуара клеток-хозяев во время ранней инфекции Leishmania amazonensis.Am Assoc Immnol; 2016. Поиск в Google Scholar
74 Wanasen N, MacLeod CL, Ellies LG, Soong L. L-аргинин и переносчик катионных аминокислот 2B регулируют рост и выживание амастигот Leishmania amazonensis в макрофагах. Инфекция и иммунитет 2007; 75: 2802-10. Искать в Google Scholar
75 Gupta G, Oghumu S, Satoskar AR. Механизмы уклонения от иммунитета при лейшманиозе. Успехи прикладной микробиологии 2013; 82: 155-84. Искать в Google Scholar
76 Ardolino M, Raulet DH.Цитокиновая терапия восстанавливает противоопухолевые ответы NK-клеток, ставших анергическими в опухолях с дефицитом MHC I. Онкоиммунология 2016; 5: e1002725. Искать в Google Scholar
77 Bhutiani N, Li Q, Anderson CD, Gu T, Egilmez NK. Комбинированная пероральная цитокиновая терапия эффективно лечит рак толстой кишки на мышиной модели. AACR; 2017. Поиск в Google Scholar
78 Ян П-М, Чжоу Ц.-Дж., Ценг С.-Х, Хунг Ц-Ф. Биоинформатика и экспериментальные анализы in vitro определяют избирательный терапевтический потенциал гамма-интерферона и апигенина против плоскоклеточного рака шейки матки и аденокарциномы.Oncotarget 2017; 8: 46145. Искать в Google Scholar
79 Brar K, Leung DY. Последние соображения по использованию рекомбинантного гамма-интерферона для биологической терапии атопического дерматита. Мнение экспертов по биологической терапии 2016; 16: 507-14. Искать в Google Scholar
80 Leiding JW, Holland SM. Хроническая гранулематозная болезнь. 2016. Поиск в Google Scholar
81 Рейн Б.А., Пауэрс Л.С., Роджерс К. и др. Интерферон-γ подавляет заражение вирусом Эбола. Патогены PLoS 2015; 11: e1005263.Искать в Google Scholar
82 Delsing CE, Gresnigt MS, Leentjens J, et al. Интерферон-гамма как дополнительная иммунотерапия при инвазивных грибковых инфекциях: серия случаев. BMC Инфекционные болезни 2014; 14: 166. Искать в Google Scholar
83 Segal BH, Walsh TJ. Современные подходы к диагностике и лечению инвазивного аспергиллеза. Американский журнал респираторной медицины и реанимации, 2006 г .; 173: 707-17. Искать в Google Scholar
84 Мальмвалл Б.Е., Фоллин П. Успешная терапия гамма-интерфероном у пациента с хронической гранулематозной болезнью (ХГБ), страдающего абсцессом печени Staphylococcus aureus и инвазивной инфекцией Candida albicans.Скандинавский журнал инфекционных болезней 1993; 25: 61-6. Искать в Google Scholar
85 Skerrett SJ, Martin TR. Интратрахеальный гамма-интерферон усиливает легочную защиту при экспериментальном легионеллезе. Am J Respir Crit Care Med 1994; 149: 50-8. Искать в Google Scholar
86 Коэльо К., Касадеваль А. Криптококковая терапия и лекарственные препараты: старые, новые и многообещающие. Клеточная микробиология 2016; 18: 792-9. Искать в Google Scholar
87 Marciano BE, Spalding C, Fitzgerald A, et al.Общие тяжелые инфекции при хронической гранулематозной болезни. Клинические инфекционные болезни 2014; 60: 1176-83. Искать в Google Scholar
88 Seger RA. Современное лечение хронической гранулематозной болезни. Британский журнал гематологии 2008; 140: 255-66. Искать в Google Scholar
89 Hashemi H, Mohebbi M, Mehravaran S, Mazloumi M, Jahanbani-Ardakani H, Abtahi S-H. Синдром гипериммуноглобулина Е: генетика, иммунопатогенез, клинические данные и методы лечения. Журнал исследований в области медицинских наук: Официальный журнал Исфаханского университета медицинских наук 2017; 22: 53.Искать в Google Scholar
90 Badaro R, Falcoff E, Badaro FS, et al. Лечение висцерального лейшманиоза пятивалентной сурьмой и гамма-интерфероном. Медицинский журнал Новой Англии 1990; 322: 16-21. Искать в Google Scholar
91 Holland SM. Иммунотерапия микобактериальных инфекций. Семинары по респираторным инфекциям; 2001. с. 47-59. Искать в Google Scholar
92 Condos R, Rom WN, Schluger NW. Лечение туберкулеза легких с множественной лекарственной устойчивостью с помощью аэрозольного гамма-интерферона.Ланцет 1997; 349: 1513-5. Искать в Google Scholar
93 Milanés-Virelles MT, García-García I, Santos-Herrera Y, et al. Адъювантный гамма-интерферон у пациентов с легочным атипичным микобактериозом: рандомизированное двойное слепое плацебо-контролируемое исследование. BMC инфекционные болезни 2008; 8: 17. Искать в Google Scholar
94 Vincent J-L, Sun Q, Dubois M-J. Клинические испытания иммуномодулирующих препаратов при тяжелом сепсисе и септическом шоке. Клинические инфекционные болезни 2002; 34: 1084-93. Искать в Google Scholar
95 Raghu G, Brown KK, Bradford WZ, et al.Плацебо-контролируемое исследование интерферона гамма-1b у пациентов с идиопатическим фиброзом легких. Медицинский журнал Новой Англии 2004; 350: 125-33. Искать в Google Scholar
96 Singhal J, Agrawal N, Vashishta M, et al. Подавление опосредованных дендритными клетками ответов генами кальциевых и цистеиновых протеазных путей во время инфекции Mycobacterium tuberculosis. Журнал биологической химии 2012; 287: 11108-21. Искать в Google Scholar
97 Green DS, Nunes AT, Annunziata CM, Zoon KC.Терапия на основе моноцитов и интерферона для лечения рака яичников. Cytokine & growth factor reviews 2016; 29: 109-15. Искать в Google Scholar
98 Windbichler G, Hausmaninger H, Stummvoll W, et al. Интерферон-гамма в терапии первой линии рака яичников: рандомизированное исследование III фазы. Британский журнал рака 2000; 82: 1138-44. Искать в Google Scholar
99 Bosserhoff A, Kortylewski M, Komyod W., Kauffmann M-E, Heinrich PC, Behrmann I. Интерферон-γ-опосредованная регуляция роста клеток меланомы: участие STAT1-зависимых и STAT1-независимых сигналов.Журнал следственной дерматологии 2004; 122: 414-22. Искать в Google Scholar
100 McCabe A, Zhang Y, Thai V, Jones M, Jordan MB, MacNamara KC. Клетки макрофагального происхождения негативно регулируют пул гемопоэтических стволовых клеток в ответ на гамма-интерферон в устойчивом состоянии и во время инфекции. Стволовые клетки 2015; 33: 2294-305. Искать в Google Scholar
101 George PM, Badiger R, Alazawi W, Foster GR, Mitchell JA. Фармакология и терапевтический потенциал интерферонов. Фармакология и терапия 2012; 135: 44-53.Искать в Google Scholar
102 Moss JW, Ramji DP. Интерферон-гамма: многообещающая терапевтическая мишень при атеросклерозе. Всемирный журнал экспериментальной медицины 2015; 5: 154-9. Искать в Google Scholar
103 Cheng X, Ding Y, Xia C, et al. Аторвастатин модулирует ответ Th2 / Th3 у пациентов с хронической сердечной недостаточностью. Журнал сердечной недостаточности 2009; 15: 158-62. Искать в Google Scholar
104 Forster O, Hilfiker-Kleiner D, Ansari AA, et al. Обратное изменение уровней IFN-гамма, oxLDL и пролактина в сыворотке коррелирует с клиническим улучшением у пациентов с перипартальной кардиомиопатией.Европейский журнал сердечной недостаточности 2008; 10: 861-8. Искать в Google Scholar
105 Лю Дж, Гао Л., Занг Д. Повышенные уровни IFN-γ в спинномозговой жидкости и сыворотке крови пациентов с боковым амиотрофическим склерозом. PloS one 2015; 10: e0136937. Искать в Google Scholar
106 Mount MP, Lira A, Grimes D, et al. Участие интерферона-γ в опосредованной микроглией потере дофаминергических нейронов. Журнал неврологии 2007; 27: 3328-37. Искать в Google Scholar
107 Gallardo E, de Andres I, Illa I.Катепсины активируются IFN-гамма / STAT1 в культуре мышц человека: возможный активный фактор дерматомиозита. Журнал невропатологии и экспериментальной неврологии 2001; 60: 847-55. Искать в Google Scholar
108 Джерати П., Грин К.М., О’Махони М., О’Нил С.Дж., Таггарт С.К., МакЭлвейни Н.Г. Ингибитор секреторной лейкоцитарной протеазы подавляет экспрессию катепсина, индуцированную интерфероном-γ. Журнал биологической химии 2007; 282: 33389-95. Искать в Google Scholar
109 Giroux M, Schmidt M, Descoteaux A.IFN-γ-индуцированная экспрессия MHC класса II: трансактивация трансактиваторного промотора IV класса II регуляторным фактором-1 IFN регулируется протеинкиназой C-α. Журнал иммунологии 2003; 171: 4187-94. Искать в Google Scholar
110 Angell TE, Lechner MG, Jang JK, LoPresti JS, Epstein AL. Потеря MHC класса I является частым механизмом выхода из иммунитета при папиллярном раке щитовидной железы, который устраняется лечением интерфероном и селуметинибом in vitro. Клинические исследования рака 2014; 20: 6034-44. Искать в Google Scholar
111 Saric T, Chang S-C, Hattori A, et al.Индуцированная IFN-γ аминопептидаза в ER, ERAP1, урезает предшественники пептидов, представленных MHC класса I. Природа иммунологии 2002; 3: 1169-76. Искать в Google Scholar
112 Wang D, Quan Y, Yan Q, Morales JE, Wetsel RA. Направленное нарушение гена β2-микроглобулина сводит к минимуму иммуногенность эмбриональных стволовых клеток человека. Трансляционная медицина стволовых клеток 2015; 4: 1234-45. Искать в Google Scholar
113 Chang JH, Kim YJ, Han SH, Kang CY. Сигнал IFN-γ-STAT1 регулирует дифференцировку индуцибельного Treg: потенциальная роль в апоптозе, опосредованном ROS.Европейский журнал иммунологии 2009; 39: 1241-51. Искать в Google Scholar
114 Lambeth JD. Ферменты NOX и биология реактивного кислорода. Нат Рев Иммунол 2004; 4: 181-9. Искать в Google Scholar
115 Rovetta AI, Pena D, Hernandez Del Pino RE, et al. IFNG-опосредованные иммунные ответы усиливают аутофагию против антигенов Mycobacterium tuberculosis у пациентов с активным туберкулезом. Аутофагия 2014; 10: 2109-21. Искать в Google Scholar
116 Tu SP, Quante M, Bhagat G, et al.Интерферон-γ подавляет канцерогенез желудка, индуцируя аутофагию эпителиальных клеток и апоптоз Т-клеток. Исследования рака 2011; 71: 4247-59. Искать в Google Scholar
117 Kim WH, Lee JW, Gao B, Jung MH. Синергетическая активация JNK / SAPK, индуцированная TNF-α и IFN-γ: апоптоз β-клеток поджелудочной железы через путь p53 и ROS. Передача сигналов в клетке 2005; 17: 1516-32. Искать в Google Scholar
118 Watanabe Y, Suzuki O, Haruyama T, Akaike T. Интерферон-γ индуцирует активные формы кислорода и стресс эндоплазматического ретикулума при апоптозе печени.Журнал клеточной биохимии 2003; 89: 244-53. Искать в Google Scholar
119 Gil MP, Bohn E, O’Guin AK, et al. Биологические последствия Stat1-независимой передачи сигналов IFN. Труды Национальной академии наук 2001; 98: 6680-5. Искать в Google Scholar
120 McNab FW, Rajsbaum R, Stoye JP, O’Garra A. Трехкомпонентные белки и регуляция врожденного иммунитета. Текущее мнение в иммунологии 2011; 23: 46-56. Искать в Google Scholar
121 Jutras I, Houde M, Currier N, et al.Модуляция протеома фагосомы интерфероном-гамма. Молекулярная и клеточная протеомика: MCP 2008; 7: 697-715. Искать в Google Scholar
122 Ghigo E, Capo C, Tung C-H, Raoult D, Gorvel J-P, Mege J-L. Выживание Coxiella burnetii в моноцитах THP-1 связано с нарушением созревания фагосом: IFN-γ опосредует его восстановление и уничтожение бактерий. Журнал иммунологии 2002; 169: 4488-95. Искать в Google Scholar
123 Santic M, Molmeret M, Abu Kwaik Y. Модуляция биогенеза Francisella tularensis subsp.novicida-содержащая фагосома в покоящихся макрофагах человека и ее созревание в фаголизосому при активации IFN-γ. Клеточная микробиология 2005; 7: 957-67. Искать в Google Scholar
124 Pei G, Bronietzki M, Gutierrez MG. Иммунная регуляция экспрессии белков Rab и внутриклеточного транспорта. Журнал биологии лейкоцитов 2012; 92: 41-50. Искать в Google Scholar
125 Huang Y, Kerin PM, Winston BW. Характеристика регуляции IFN-гамма гена фактора комплемента B в макрофагах.Eur J Immunol 2001; 31: 3676-86. Искать в Google Scholar
126 Gasque P, Dean YD, McGreal EP, VanBeek J, Morgan BP. Компоненты дополнения врожденной иммунной системы при здоровье и заболеваниях ЦНС. Иммунофармакология 2000; 49: 171-86. Искать в Google Scholar
127 Carroll MC.
 И. О., пол, дату и место рождения, данные паспорта или загранпаспорта, номер СНИЛС. Нажмите «Сохранить и продолжить».
И. О., пол, дату и место рождения, данные паспорта или загранпаспорта, номер СНИЛС. Нажмите «Сохранить и продолжить».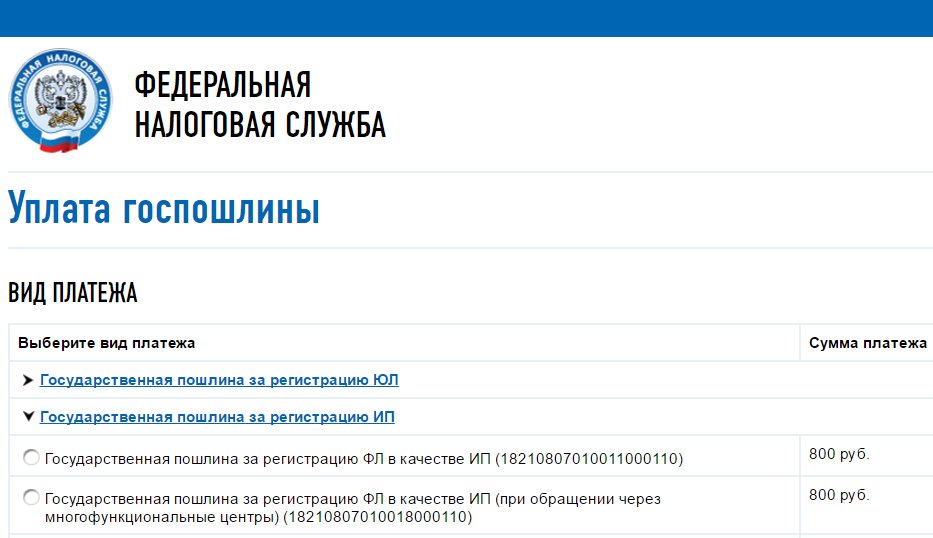
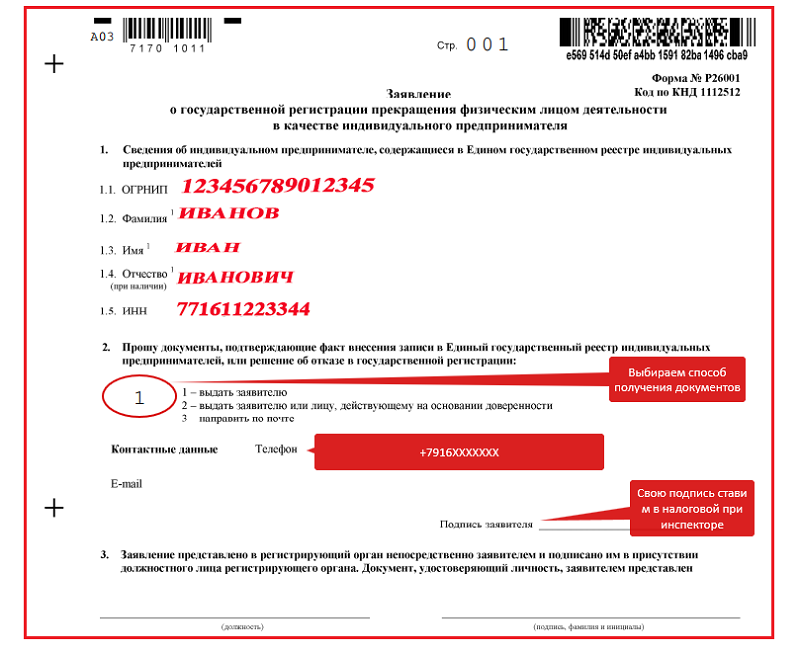
 Подпись на заявлении должна быть заверено в нотариальном порядке.
Подпись на заявлении должна быть заверено в нотариальном порядке.