СМИ: ученые из США разработали метод, расширяющий возможности пересадки почки — Наука
НЬЮ-ЙОРК, 10 марта. /ТАСС/. Американские ученые разработали метод, позволяющий пересаживать почку от живого донора пациентам, для которых такая операция ранее считалась невозможной из-за несовместимости. Об этом сообщила газета The New York Times.
На эту тему
Новый метод, разработанный группой ученых под руководством профессора Дорри Сегева из школы медицины при Университете Джона Хопкинса, позволит проводить операции по трансплантации людям с очень чувствительной иммунной системой, для которых было крайне трудно или даже невозможно подобрать донора. Процедура под названием «десенсибилизация», или снижение чувствительности, заключается в полном устранении из крови человека, нуждающегося в трансплантации, антител, которые отторгают донорский орган. Она производится при помощи специальных фильтров. При этом новые антитела, которые вырабатываются организмом после этой процедуры, по не известной ученым причине, с меньшей силой, чем раньше, отторгают пересаженный орган.
На эту тему
Разработка нового метода продолжалась восемь лет, за это время почки от несовместимых живых доноров были пересажены более чем тысяче пациентов. Ученые установили, что выжили 76,5% пациентов, которым была сделана такая операция в сочетании с процедурой «десенсибилизации». Этот показатель выше, чем у пациентов, которым был трансплантирован совместимый орган, взятый у мертвого донора (62,9% выживших), или у тех, кто ожидает пересадки почки, регулярно проходя процедуру диализа (искусственного очищения крови и других жидкостей в организме, — прим. ТАСС).
Процедура «десенсибилизации» обходится в $30 тыс. в дополнение к самой операции по пересадке почки, которая в США стоит около $100 тыс. Однако в долгосрочной перспективе новый метод призван не только спасти жизни, но и сэкономить средства, так как регулярное прохождение курса диализа обходится пациенту в США в $70 тыс. в год, отмечает газета.
Ученые в США создали в лаборатории действующую почку
Подпись к фото,Успешно функционирующая искусственно выращенная почка обещает сделать революцию в трансплантологии
Искусственная почка, выращенная в лабораторных условиях в Бостоне и успешно пересаженная крысе, начала функционировать.
Ученые и раньше выращивали отдельные органы и даже пересаживали их людям, однако до сих пор искусственно созданные почки были менее эффективны, чем настоящие.
Теперь исследователи в области регенеративной медицины уверены, что перед ними открываются огромные возможности.
Почки отвечают за очистку крови и выводят из нее излишнюю воду и продукты жизнедеятельности организма.
Это один из самых востребованных органов в трансплантологии — пациенты вынуждены подолгу дожидаться донорских почек.
Биоинженеры надеются в будущем очищать старую почку от прежних клеток, оставляя сотовую структуру, которая потом послужит «лесами» для строительства нового органа.
Такая техника дает два важных преимущества перед донорскими органами.
Во-первых, поскольку почка состоит из тканей самого пациента, ему не понадобится всю жизнь принимать иммуноподавляющие препараты, предотвращающие отторжение органа.
И во-вторых, значительно увеличится число органов для трансплантации, поскольку сейчас большинство трансплантатов отторгается и подлежит уничтожению, но теперь их можно будет использовать в качестве матрицы для новых органов.
И 5% — успех
Исследователи из Главной больницы Массачусетса сделали первые шаги на пути к созданию искусственно выращенных почек.
В качестве образца они взяли почку крысы и с помощью растворителя очистили ее от старых клеток, оставив лишь белковую матрицу, которая повторяет сеть кровеносных сосудов.
Затем по этой сети в матрицу были закачаны нужные клетки, которые срослись с «лесами» и образовали новый орган.
Во время строительства почка 12 дней находилась в условиях, имитирующих тело крысы.
После тестирования почка смогла производить мочу, хотя лишь на четверть от объема нормального органа.
После этого ученые пересадили почку крысе, но ее работоспособность при этом упала на 5%.
Но даже это, по словам доктора Харальда Отта, возглавляющего исследования, вполне достаточно.
«Если вы были на диализе, то восстановление работы почки до 10-15% уже позволяет вам отказаться от этой процедуры, — напоминает доктор Отт. — А если вспомнить о том, что только в США 100 тысяч пациентов дожидаются донорской почки, а в год пересаживают лишь 18 тысяч, то потенциально клинический эффект нашей разработки может быть огромен».
Впечатляющие результаты
Разумеется, прежде чем новую технологию удастся опробовать на людях, понадобится еще немало исследований.
Необходимо существенно увеличить производительность такой почки и убедиться в том, что она способна будет долго работать.
Кроме того — в отличие от экспериментальной — человеческая почка значительно больше, и наращивание на ней клеток может оказаться куда более сложной задачей.
«Это чрезвычайно интересный и очень впечатляющий эксперимент, — заявил хирург Университетского колледжа Лондона профессор Мартин Берчилл, занимавшийся трансплантацией трахеи, выращенной на матрице. — Им удалось преодолеть основные технические барьеры, которые стояли на пути регенеративной медицины».
— Им удалось преодолеть основные технические барьеры, которые стояли на пути регенеративной медицины».
эволюция и принципы работы — Российская газета
По данным ВОЗ, более чем у 500 миллионов человек во всем мире — то есть примерно у каждого десятого взрослого — отмечаются признаки нарушения функции почек. К развитию почечной недостаточности приводят сахарный диабет и повсеместно распространенная артериальная гипертония. Иметь железное здоровье — это ли не предел мечтаний? Не исключено, что выращивание и имплантация человеческих органов будут возможны уже в обозримом будущем. Пока же функции организма поддерживают различные аппараты. Например, искусственная почка.
Все началось с пиявок
Еще ученых античности интересовала процедура гемодиализа, но толчком к появлению современного метода очистки крови стало развитие биохимии в начале XIX века.
С. В. Лашутин в книге «История гемодиализа в мире» отмечает несколько основных вех становления этого направления медицины.
В 1854 году был описан метод изготовления полупроницаемых пергаментных мембран: шотландский профессор химии Томас Грэхэм спроектировал диализатор в форме «обруча», экспериментально доказав законы диффузии и осмоса (от греческого «давление»), ставшие классическими и заложившие основы современного диализа.
Первый гемодиализ был проведен в октябре 1924 года. Врач из Германии Джордж Хаас в качестве антикоагулянта использовался гирудин: вещество, которое содержится в слюнных железах пиявок и в некоторых видах змеиного яда. В 1925 году Хаас после нескольких неудачных попыток смог произвести свою первую партию гепарина из печени и в 1927 году впервые использовал его в лечении больного гемодиализом.
3 сентября 1945 года голландскому медику Вильяму Кольфу удалось с помощью гемодиализа снизить концентрацию мочевины в крови пациентки и вывести ее из комы. Таким образом, первой больной, которая выжила благодаря лечению искусственной почкой, считается эта 67-летняя женщина.
В условиях больницы
За десятилетия своего существования гемодиализ стал вполне самостоятельной медицинской специальностью. На сегодня именно внепочечное очищение крови при всех своих побочных эффектах, таких как болезненность процедуры, повышенная утомляемость и кожный зуд, считается наиболее универсальным и доступным методом лечения заболеваний почек.
На сегодня именно внепочечное очищение крови при всех своих побочных эффектах, таких как болезненность процедуры, повышенная утомляемость и кожный зуд, считается наиболее универсальным и доступным методом лечения заболеваний почек.
Современная искусственная почка представляет собой довольно громоздкое устройство весом несколько десятков килограммов. Для очищения крови от продуктов метаболизма пациентам амбулаторно проходятся проходить 2-3 сеанса в неделю по 4-8 часов каждый. Так, в 2008 году в Свердловской области, жительница Новоуральска, страдающая почечной недостаточностью и пытавшаяся родить ребенка, проводила подключенной к аппарату по нескольку часов каждый день.
Современные данные говорят о том, что на каждой процедуре гемодиализа должно достигаться очищение крови от мочевины не менее чем на 65 процентов.
Диализатор имеет две части: одну — для крови пациента, вторую — для специального раствора. Эти две части разделяет тонкая мембрана, отверстия в которой имеют такой размер, что клетки крови, белок и другие важные компоненты крови не могут пройти через мембрану и остаются в организме, а шлаки, такие как мочевина, калий и лишняя жидкость, удаляются.
«Диализ снижает концентрацию уремических токсинов в плазме крови, нормализует кислотно-щелочной равновесие крови и ее электролитный состав, удаляет из крови избыточную жидкость, создает предпосылки для нормализации артериального давления и коррекции анемии. Очищенная таким образом кровь возвращается в ткани тела и принимает на себя снова находящиеся в них уремические токсины — цикл повторяется», — описывает процесс в своей книге специалист в области гемодиализа Е. А. Стецюк. И добавляет, что по сути своей гемодиализ не является методом лечения заболеваний почек — это лишь способ частичного замещения утраченной функции внутренних органов.
Портативная помощь
В 2007 году американские доктора выступили с заявлением, что разработали переносную искусственную почку. Испытания нового устройства в 2009 показали неплохие результаты. Аппарат, в отличие от своего стационарного предшественника, небольшой: весит всего около 4 килограммов, легко помещается в сумке и работает от батареек в течение 6-8 часов.
Процедура подключения устройства к пациенту занимает несколько минут: врач соединяет аппарат с веной в области предплечья или бедра, и почка начинает функционировать. Человек может носить устройство при себе круглосуточно, занимаясь текущими делами. Правда, по данным специалистов, процедура очистки крови в портативной искусственной почке происходит несколько медленнее, чем в стационарном аппарате.
Первый аппарат мобильной искусственной почки был протестирован в лабораторных условиях в 2004 году американским ученым Чарльзом Дженнингсом. В сопроводительных документах, зарегистрированных в патентном бюро США в 2006 году, аппарат описывается как «устройство, подсоединяемое к подвздошной артерии пациента». Очистка проходит как при стационарном диализе: с помощью мембранных картриджей молекулы воды, магния, натрия, калия, кальция, мочевина и так далее удаляются из крови согласно их атомной массе.
Эффективность такого подхода даже у самых тяжелых больных была подтверждена исследованиями.
Имплантат будущего
В 2010 году калифорнийские светила медицины разработали имплантируемый гемодиализный аппарат, размерами сопоставимый с человеческой почкой. Уже в сентябре 2013 года американская корпорация заявила, что заканчивает работу над новым устройством, которое может стать настоящим прорывом в лечении почечной недостаточности. По некоторым оценкам, диализ с помощью этого устройства настолько эффективен, что может заменить трансплантацию донорской почки.
Тестирование мобильной почки продолжается и если проверка пройдет успешно, то уже через год начнутся ее испытания на свиньях. Устройство размером с мобильный или пачку сигарет можно будет и трансплантировать, и просто носить на теле, если трансплантация противопоказана.
Принцип работы такой почки отличается от обычных диализных аппаратов: помимо микрофильтров в ней есть биореактор с клетками почечных канальцев. «Новое устройство для диализа состоит из волокон, выстланных почечными клетками, которые отвечают за обратное всасывание воды, глюкозы и других необходимых организму веществ, а также выработку молекул, обеспечивающих иммунитет», — передает BBC News.
То есть по сути своей аппарат выполняет метаболические функции почек. Существенное преимущество прибора в том, что он не требует дополнительного питания — фильтрация в нем происходит за счет энергии кровотока.
Кстати
В апреле 2013 года биологи из США впервые вырастили полноценную искусственную почку и успешно пересадили ее в тело крысы.
Справка «РГ»
Хроническая почечная недостаточность — состояние больного в результате сокращения, а затем и полного прекращения функции почек. В крови накапливаются вредные вещества, избыток жидкости. Если не принять срочные меры, то человек погибнет.
цены на прием уролога и проведение операций в клинике МЕДСИ в Санкт-Петербурге.
Открытая резекция
В настоящий момент такое вмешательство проводится все реже. Это связано с рядом рисков и послеоперационных осложнений. Открытые вмешательства проводятся с целью лечения гидронефроза (если противопоказано использование иных методик) или удаления почки.
После проведения основных манипуляций на брюшную полость накладывается шов. Также обязательным является дренаж, позволяющий обеспечить отток лишней жидкости. После вмешательства у пациента длительное время сохраняется отек. Восстановительный период нередко затягивается на несколько месяцев, так как повреждаются большие объемы тканей.
Лапароскопические операции по удалению опухолей почки, камней и др.
Такие вмешательства можно проводить с минимальными надрезами. Благодаря этому сокращаются риски осложнений. Манипуляции выполняются через небольшие проколы. В них вводится лапароскоп и другие хирургические инструменты. За всеми манипуляциями хирург может следить с помощью специального монитора. После окончания вмешательства инструменты вынимаются. Дренирование не требуется.
После окончания вмешательства инструменты вынимаются. Дренирование не требуется.
Одной из популярных разновидностей лапароскопических операций является литотрипсия – операция по удалению камней из почек. Через прокол к месту образований вводятся инструменты, подающие ультразвуковые волны. Благодаря такому воздействию камни можно раздробить до состояния пыли. Остатки образований вымываются через мочеточник с использованием специальных инструментов. Это способствует сокращению сроков реабилитации пациента.
Эндоурологические операции
Такие вмешательства проводятся без разрезов и проколов мягких тканей. Эндоскоп вводится через уретральный канал. Это и позволяет хирургу выполнять все необходимые манипуляции. Для визуального доступа к внутренним органам используется рентгеновское или УЗ-оборудование. Подобные хирургические вмешательства достаточно сложны, поэтому проводиться они должны только опытными специалистами, владеющими всеми методиками.
Экстракорпоральная резекция
Эта операция является одной из самых сложных и требует длительной подготовки. Во время вмешательства почку отсекают и вынимают из тела пациента. После этого орган помещается в специальную жидкость и тщательно промывается. Затем пораженная часть органа удаляется. После этого сосуды почки заполняют раствором, замещающим кровь. Внешние разрезы зашиваются. После этого орган возвращают обратно. Назначается такая операция по поводу удаления кист на почке и других образований.
Нефрэктомия
Такая операция назначается при раке почки. Вмешательство направлено на полное удаление органа вместе с лимфатическими узлами и пораженными участками. После окончания основных манипуляций накладываются швы, и обязательно устанавливается система дренажа для отвода избытка жидкости.
Нефропексия
Эта операция проводится при постановке диагноза «блуждающая почка». Вмешательство не требует полостной резекции. Все манипуляции производятся через небольшой прокол. В образованную полость вводится эндоскоп, с помощью которого хирург осуществляет свою работу. Манипуляция обычно не имеет серьезных осложнений и отличается небольшим периодом реабилитации.
Вмешательство не требует полостной резекции. Все манипуляции производятся через небольшой прокол. В образованную полость вводится эндоскоп, с помощью которого хирург осуществляет свою работу. Манипуляция обычно не имеет серьезных осложнений и отличается небольшим периодом реабилитации.
Выбор в пользу конкретной методики проведения операции по удалению почки, опухоли и другой терапии делает только врач. В сложных случаях разбор ситуации проводится консилиумом специалистов.
Биоинженерная почка, созданная из клеток крысы и человека, показала свою работоспособность в организме крысы
Чтобы сделать пригодную для пересадки почку, ученым пришлось лишить ее собственных клеток и заселить почечный каркас другими клетками. Испытание на крысе прошло успешно: почка фильтрует кровь и производит мочу. Хотя пока биоинженерный орган по качеству работы не дотягивает до обычного.
Почку пересаживают чаще всех прочих органов: трансплантация — единственный радикальный способ вылечить больного с почечной недостаточностью. Гемодиализ, то есть очищение крови вне организма, — это лишь временное решение проблемы, до получения донорского органа. В США около одного миллиона пациентов с таким диагнозом, причем каждый год его ставят примерно 100 тысячам человек. 100 тысяч больных ждут донорскую почку, и только 18 тысяч ежегодно ее получают. В листе ожидания почки ежегодная смертность составляет 5–10%.
Гемодиализ, то есть очищение крови вне организма, — это лишь временное решение проблемы, до получения донорского органа. В США около одного миллиона пациентов с таким диагнозом, причем каждый год его ставят примерно 100 тысячам человек. 100 тысяч больных ждут донорскую почку, и только 18 тысяч ежегодно ее получают. В листе ожидания почки ежегодная смертность составляет 5–10%.
Недостаток донорских органов — первая проблема трансплантологии.
Вторая проблема — людям с пересаженным органом надо пожизненно принимать иммуносупрессанты для подавления иммунитета и, соответственно, подвергаться риску различных заболеваний. У 20% пациентов все равно возникают эпизоды острого отторжения донорской почки в течение 5 лет после трансплантации. 40% умирают или теряют функции пересаженной почки в течение 10 лет после трансплантации. Создание пригодной для пересадки биоинженерной почки позволит спасти множество жизней.
40% умирают или теряют функции пересаженной почки в течение 10 лет после трансплантации. Создание пригодной для пересадки биоинженерной почки позволит спасти множество жизней.
В области создания биоинженерных органов развиваются два принципиально разных направления: одно основано на возможностях 3D-биопечати тканей и органов, другое — на использовании естественных или синтетических каркасов, которые засеваются стволовыми клетками. Ученые Массачусетской больницы общего профиля (Massachusetts General Hospital) пошли по второму пути.
Они создали почку из каркаса почки крысы, который заселили соответствующими клетками крысы и человека.
Биоинженерную почку трансплантировали в организм крысы и убедились в ее работоспособности. Результаты работы исследователи опубликовали в журнале Nature Medicine. Пересаженная почка выполняла все свои функции: пропускала кровь по сосудам, фильтровала, абсорбировала и выделяла мочу.
«Уникальным в этом подходе является то, что мы полностью сохранили архитектуру органа, так что биоинженерный трансплантат фактически ничем не отличался от донорской почки и встраивался в кровеносную и в выделительную системы», — сказал Харальд Отт, сотрудник Центра регенеративной медицины Массачусетской клиники, первый автор статьи.
Сначала ученые взяли почку крысы и полностью удалили из нее клетки. Эта операция — децеллюризация, производится путем перфузирования (промывания) органа детергентным раствором, вымывающим клетки. В результате они получили лишенный клеток каркас почки, состоящий в основном из коллагена, полностью сохраняющий структуру органа. Что очень важно, сохранялась микроструктура основных элементов почки — нефронов, состоящих из почечного тельца с клубочком капилляров внутри и системы канальцев.
Этот каркас почки крысы заселили новыми клетками, причем для конструирования полноценной почки надо было использовать клетки нескольких типов.
Взяли клетки эндотелия (внутренней стенки) кровеносных сосудов человека и клетки почечного эпителия новорожденной крысы. Для того чтобы поместить их в нужные места, эндотелиальные клетки доставлялись путем введения через почечную артерию, а клетки почечного эпителия вводили через уретру. Микроструктурный анализ показал, что при таком способе доставки клетки первого типа заселяли кровеносные сосуды и капилляры внутри клубочков, а клетки второго типа закреплялись в почечных тельцах и канальцах. После этого почка дозревала в биореакторе в течение 12 дней.
Для того чтобы поместить их в нужные места, эндотелиальные клетки доставлялись путем введения через почечную артерию, а клетки почечного эпителия вводили через уретру. Микроструктурный анализ показал, что при таком способе доставки клетки первого типа заселяли кровеносные сосуды и капилляры внутри клубочков, а клетки второго типа закреплялись в почечных тельцах и канальцах. После этого почка дозревала в биореакторе в течение 12 дней.
Готовую биоинженерную почку проверили на работоспособность. Сначала через почку пропускали кровь in vitro, вне организма. В результате фильтрации и обратного всасывания воды и питательных веществ почка образовывала мочу. Затем ученые проверили почку in vivo — пересадили биоинженерный орган крысе с удаленной собственной почкой. Операция прошла удачно, почку подсоединили к кровеносной и выделительной системе. Оказавшись в организме, почка стала выполнять свою функцию и выделять мочу.
Работу почки исследователи оценили по нескольким параметрам – скорость фильтрации крови, выделение креатинина (продукта распада белков), обратное всасывание глюкозы и электролитов.
Пока, пишут авторы, по всем показателям функция биоинженерной почки снижена по сравнению с обычной донорской почкой.
Как они полагают, частично это может быть связано с незрелостью клеток новорожденной крысы, которыми засевали каркас. В дальнейшем они собираются выращивать клетки в культуре до их созревания и тем самым добиться получения функционально полноценной биоинженерной почки.
«Если эта технология окажется применима к размерам человеческой почки, пациенты, страдающие от почечной недостаточности, которые многие годы ждут донорскую почку, получат альтернативу – биоинженерную почку, заселенную их собственными клетками», — говорит Харальд Отт.
Шаг к этому уже сделан: исследователи подвергли процедуре децеллюризации почку, взятую от умершей свиньи, и почку, взятую от умершего человека.
Процедура оказалась успешной: им удалось получить каркас почки человека с сохранением его микроструктуры. Сейчас ученые изучают методы получения нужных типов клеток от пациента и выращивания их в культуре в количестве, необходимом для засевания каркаса человеческого размера. В идеале каркас нужно засевать собственными клетками пациента, что полностью исключит отторжение органа. Так что ученые надеются, что со временем биоинженерная почка сможет полностью заменить донорскую (для пересадки больным с почечной недостаточностью).
Побочные эффекты вакцинации против COVID-19
Появление побочных эффектов в диапазоне от легких до умеренно выраженных, например повышения температуры тела или боли в мышцах, является вариантом нормы и не должно вызывать беспокойства: это свидетельствует о реакции иммунной системы на введение\r\n вакцины, в частности на антиген (вещество, запускающее иммунный ответ), а также подготовку к борьбе с вирусом. Данные побочные эффекты, как правило, исчезают самостоятельно по прошествии нескольких дней.
Распространенные побочные эффекты легкой или умеренной степени выраженности полезны, так как они свидетельствуют о результативности введения вакцины. Отсутствие побочных эффектов не означает отсутствия эффекта от вакцины. Оно свидетельствует об индивидуальном\r\n характере реакций организма.
Частые побочные эффекты вакцин против COVID-19
Введение вакцин против COVID-19, как и любых других вакцин, может вызывать побочные эффекты, преимущественно в диапазоне от легких до умеренно выраженных, которые самостоятельно разрешаются в течение нескольких дней. По данным клинических испытаний, возможно\r\n появление более серьезных или продолжительных побочных эффектов. За использованием вакцин ведется непрерывный мониторинг на предмет выявления нежелательных явлений.
Побочные эффекты вакцин против COVID-19 в большинстве случаев носят легкий или умеренный характер и являются непродолжительными. К типичным побочным эффектам относятся боль в месте инъекции, лихорадка, утомляемость, головные боли, боли в мышцах, озноб\r\n и диарея. Вероятность возникновения какого-либо из указанных побочных эффектов может быть разной в зависимости от конкретной вакцины.
Вероятность возникновения какого-либо из указанных побочных эффектов может быть разной в зависимости от конкретной вакцины.
Вакцины против COVID-19 обеспечивают защиту только от вируса SARS-CoV-2, поэтому необходимо и далее придерживаться мер профилактики заболеваний и здорового образа жизни.
Редкие побочные эффекты
После введения вакцины необходимо попросить пациента задержаться в пункте вакцинации на 15–30 минут, с тем чтобы обеспечить своевременное оказание медицинской помощи в случае возникновения реакций немедленного типа. В случае возникновения непредвиденных\r\n побочных эффектов или других расстройств здоровья, таких как побочные эффекты продолжительностью свыше трех дней, вакцинированные лица должны уведомить о них работников здравоохранения по месту жительства. К числу описанных редких побочных эффектов\r\n вакцинации против COVID-19 относятся тяжелые аллергические реакции, например анафилактические; однако эти реакции происходят крайне редко.
Национальные руководящие органы и международные организации, в том числе ВОЗ, проводят тщательный мониторинг любых побочных эффектов, связанных с применением вакцины против COVID-19.
Долгосрочные побочные эффекты
Как правило, побочные эффекты развиваются в течение первых нескольких дней после введения вакцины. Первая программа массовой вакцинации стартовала в начале декабря 2020 г., уже сделаны миллионы прививок, и период возникновения побочных эффектов,\r\n о которых имеется информация, составляет всего несколько дней.
Высказывались опасения относительно того, что вакцины против COVID-19 могут провоцировать заболевание COVID-19. Однако ни в одной из одобренных к применению вакцин не содержится жизнеспособного вирусного возбудителя COVID-19, в связи с чем вакцинация\r\n против COVID-19 не может стать причиной заражения COVID-19.
Как правило, иммунитет к вирусу SARS-CoV-2, вызывающему заболевание COVID-19, вырабатывается в течение нескольких недель. Таким образом, существует вероятность заражения вирусом SARS-CoV-2 незадолго до или после вакцинации и заболевания COVID-19. Это\r\n связано с тем, что для обеспечения защиты прошло недостаточно времени с момента вакцинации.
Появление побочных эффектов после вакцинации означает, что вакцина действует и иммунная система реагирует необходимым образом. Вакцины безопасны, и вакцинация способствует защите от COVID-19.
«,»datePublished»:»2021-03-31T21:00:00.0000000+00:00″,»image»:»https://cdn.who.int/media/images/default-source/vaccines-explained/who_ve_topic-9_banner.jpg?sfvrsn=81363cb3_26″,»publisher»:{«@type»:»Organization»,»name»:»World Health Organization: WHO»,»logo»:{«@type»:»ImageObject»,»url»:»https://www.who.int/Images/SchemaOrg/schemaOrgLogo.jpg»,»width»:250,»height»:60}},»dateModified»:»2021-03-31T21:00:00.0000000+00:00″,»mainEntityOfPage»:»https://www.who.int/ru/news-room/feature-stories/detail/side-effects-of-covid-19-vaccines»,»@context»:»http://schema.org»,»@type»:»Article»};
Орхидея: все о выращивании и размножении капризного цветка
https://ria.ru/20201204/orkhideya-1587661151.html
Орхидея: все о выращивании и размножении капризного цветка
Орхидея: все о выращивании и размножении капризного цветка — РИА Новости, 06. 10.2021
10.2021
Орхидея: все о выращивании и размножении капризного цветка
Орхидея – это тропический цветок, который в последние годы полюбился россиянам. Как ухаживать за растением в домашних условиях – в материале РИА Новости. РИА Новости, 06.10.2021
2020-12-04T13:36
2020-12-04T13:36
2021-10-06T17:46
в мире
растения
растениеводство
цветы
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/156091/43/1560914352_0:37:2820:1624_1920x0_80_0_0_036c9fa41f69844c3663be6e204e3ea8.jpg
МОСКВА, 4 дек — РИА Новости. Орхидея – это тропический цветок, который в последние годы полюбился россиянам. Как ухаживать за растением в домашних условиях – в материале РИА Новости.По легенде, орхидея появилась на земле «из осколка радуги». Более 90% видов этого растения произрастают в тропическом климате Южной Америки. Но самый популярный комнатный цветок – орхидея фаленопсис – родом из Юго-Восточной Азии. С греческого название переводится как «похожий на бабочку».- Декоративный тропический цветок орхидея фаленопсис больше всего подходит для оформления гостиной. А вот держать ее в спальне, особенно молодых людей или новобрачных, нежелательно. Считается, что именно этот цветок мешает молодым парам, — рассказала РИА Новости мастер-флорист Серафима Агеенко.Особенности ухода за орхидеейОсвещенностьНесмотря на то, что фаленопсис считается самой неприхотливой из всех орхидей, он все равно требует соблюдения определенных правил в домашних условиях произрастания.В солнечных субтропиках растение привыкло жить в полутени деревьев, потому в домах его лучше ставить на подоконниках, но без прямых солнечных лучей. Оно очень быстро привыкает к своему месту и не любит переездов даже на другой, настолько же освещенный, подоконник.Также стоит учесть, что орхидее нужен прозрачный горшок. Ее корни должны получать свет, так как в природе они пребывают на воздухе — прикрепляются к коре деревьев, зарываются в мох.
С греческого название переводится как «похожий на бабочку».- Декоративный тропический цветок орхидея фаленопсис больше всего подходит для оформления гостиной. А вот держать ее в спальне, особенно молодых людей или новобрачных, нежелательно. Считается, что именно этот цветок мешает молодым парам, — рассказала РИА Новости мастер-флорист Серафима Агеенко.Особенности ухода за орхидеейОсвещенностьНесмотря на то, что фаленопсис считается самой неприхотливой из всех орхидей, он все равно требует соблюдения определенных правил в домашних условиях произрастания.В солнечных субтропиках растение привыкло жить в полутени деревьев, потому в домах его лучше ставить на подоконниках, но без прямых солнечных лучей. Оно очень быстро привыкает к своему месту и не любит переездов даже на другой, настолько же освещенный, подоконник.Также стоит учесть, что орхидее нужен прозрачный горшок. Ее корни должны получать свет, так как в природе они пребывают на воздухе — прикрепляются к коре деревьев, зарываются в мох. Кроме того, их не стоит полностью погружать в емкость. Можно частично оставить на поверхности.Температурный режимКомнатная орхидея будет комфортно себя чувствовать при температуре воздуха от 20 до 27 градусов в помещении днем, ночью от 14 до 24 градусов.Полив и влажность воздухаЭтому растению требуется достаточно высокая влажность воздуха в доме, потому будет полезным поставить рядом с горшком аквариум, поддон или банку с водой или увлажнитель воздуха.Активно поливать орхидею не стоит. Раза в неделю будет достаточно, иначе корни могут загнить. После полива они не должны оставаться в воде, поэтому не забывайте сливать ее из поддона.Удобрение орхидеиСуществует два вида подкормки орхидей – внекорневая и корневая. Суть первой в опрыскивании раствором удобрения листьев, второй – в смачивании корней.Перед периодом ожидаемого цветения лучше всего подкармливать растение удобрением с высоким содержанием калия и фосфора. Это обеспечит яркость и пышность бутонов и правильное развитие корневой системы.
Кроме того, их не стоит полностью погружать в емкость. Можно частично оставить на поверхности.Температурный режимКомнатная орхидея будет комфортно себя чувствовать при температуре воздуха от 20 до 27 градусов в помещении днем, ночью от 14 до 24 градусов.Полив и влажность воздухаЭтому растению требуется достаточно высокая влажность воздуха в доме, потому будет полезным поставить рядом с горшком аквариум, поддон или банку с водой или увлажнитель воздуха.Активно поливать орхидею не стоит. Раза в неделю будет достаточно, иначе корни могут загнить. После полива они не должны оставаться в воде, поэтому не забывайте сливать ее из поддона.Удобрение орхидеиСуществует два вида подкормки орхидей – внекорневая и корневая. Суть первой в опрыскивании раствором удобрения листьев, второй – в смачивании корней.Перед периодом ожидаемого цветения лучше всего подкармливать растение удобрением с высоким содержанием калия и фосфора. Это обеспечит яркость и пышность бутонов и правильное развитие корневой системы.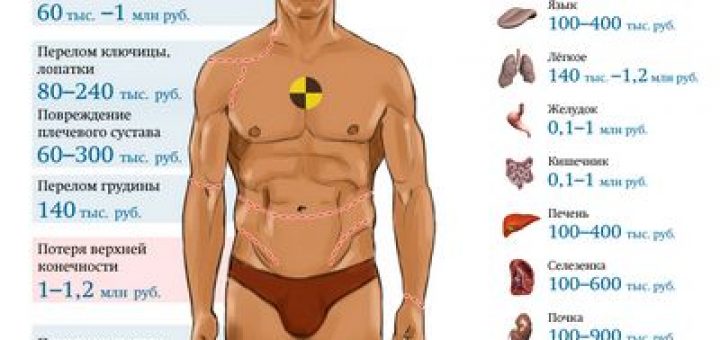 Применять подкормку следует примерно 4 раза с интервалом в две недели.Если удобрения не применялись до цветения, то и после их использовать нельзя, так как из-за этого растение быстрее отцветет.В момент отдыха орхидеи лучше давать ей удобрения с азотом. Он нужен для наращивания листовой массы. Определить недостаток азота можно по замедленному росту и мелким листовым пластинам. Дозировка подкормки рассчитывается в строгом соответствии с инструкцией на упаковке. Необходимо помнить, что орхидеи очень чувствительны к переизбытку азота и могут погибнуть даже из-за небольшого превышения концентрации.Пересадка орхидеи в домашних условияхПересаживают растение по мере разрушения субстрата из коры сосны, мха сфагнума, торфа и угля. Через 2-3 года после покупки орхидеи корневая система успевает сильно разрастись в горшке, а сосновая кора превратиться почти в труху.Начинать процесс «переезда» во время цветения нельзя. Лучше сделать это через две недели после того, как цветы опадут.Пересадку орхидеи не любят, потому эту процедуру стоит повторять не чаще чем раз в 2-3 года.
Применять подкормку следует примерно 4 раза с интервалом в две недели.Если удобрения не применялись до цветения, то и после их использовать нельзя, так как из-за этого растение быстрее отцветет.В момент отдыха орхидеи лучше давать ей удобрения с азотом. Он нужен для наращивания листовой массы. Определить недостаток азота можно по замедленному росту и мелким листовым пластинам. Дозировка подкормки рассчитывается в строгом соответствии с инструкцией на упаковке. Необходимо помнить, что орхидеи очень чувствительны к переизбытку азота и могут погибнуть даже из-за небольшого превышения концентрации.Пересадка орхидеи в домашних условияхПересаживают растение по мере разрушения субстрата из коры сосны, мха сфагнума, торфа и угля. Через 2-3 года после покупки орхидеи корневая система успевает сильно разрастись в горшке, а сосновая кора превратиться почти в труху.Начинать процесс «переезда» во время цветения нельзя. Лучше сделать это через две недели после того, как цветы опадут.Пересадку орхидеи не любят, потому эту процедуру стоит повторять не чаще чем раз в 2-3 года. Субстрат для растения можно приобрести в готовом виде в магазине. А при выборе нового прозрачного горшка стоит учесть, что он должен быть на 1-2 размера больше предыдущего.Перед пересадкой орхидею необходимо полить, разбередить субстрат и аккуратно вынуть растение. Затем нужно промыть корни водой, удалить сгнившие части секатором. Срезы присыпать молотой корицей или углем.После этого нужно дать орхидее просохнуть около шести часов, а по прошествии этого времени поместить в горшок, на дно которого уложен для устойчивости груз, например, небольшой камень. Корни растения нужно расправить, пустоты заполнить субстратом. Если некоторые корни не улеглись в горшок, оставьте их на поверхности. Затем стоит полить растение, чтобы кора просела.Пересаженную орхидею оставляют в притененном месте на две недели, чтобы уберечь ее от излишнего света и перегрева.Способы размножения в домашних условияхОрхидею размножают после цветения при влажности примерно 80% и температуре около 30 градусов. При этом у растения не должно быть признаков заболевания.
Субстрат для растения можно приобрести в готовом виде в магазине. А при выборе нового прозрачного горшка стоит учесть, что он должен быть на 1-2 размера больше предыдущего.Перед пересадкой орхидею необходимо полить, разбередить субстрат и аккуратно вынуть растение. Затем нужно промыть корни водой, удалить сгнившие части секатором. Срезы присыпать молотой корицей или углем.После этого нужно дать орхидее просохнуть около шести часов, а по прошествии этого времени поместить в горшок, на дно которого уложен для устойчивости груз, например, небольшой камень. Корни растения нужно расправить, пустоты заполнить субстратом. Если некоторые корни не улеглись в горшок, оставьте их на поверхности. Затем стоит полить растение, чтобы кора просела.Пересаженную орхидею оставляют в притененном месте на две недели, чтобы уберечь ее от излишнего света и перегрева.Способы размножения в домашних условияхОрхидею размножают после цветения при влажности примерно 80% и температуре около 30 градусов. При этом у растения не должно быть признаков заболевания. Первый способ — размножить орхидею семенами. Однако это сложно, да и получится сделать только в условиях теплицы. Дома же пользуются более простым способом – рассаживают стебелек с воздушными корнями. Он вырастает на цветоносе после завершения цветения. Будущее самостоятельное растение отделяют от основного, сажают в привычный для него субстрат и создают для комфорта необходимую влажность.Есть и третий способ – черенкование стебля цветоноса. Его разрезают на фрагменты так, чтобы в центре каждого осталась спящая почка. Затем черенки укладывают в контейнер с влажным мхом сфагнумом, а сверху затягивают целлофановым пакетом или пленкой. Вскоре почки прорастут и образуют деток — небольшие отростки, которые можно выращивать.Самый долгий способ размножения орхидей — выращивание деток на самом растении. Для этого «будят» спящую почку в температуре до 29 градусов. После этого около основания чешуи надрезают кору цветоноса. Почку оголяют при помощи пинцета и обрабатывают цитокиновой пастой для защиты от болезней, затем прикрывают кусочком сфагнума на месяц-полтора.
Первый способ — размножить орхидею семенами. Однако это сложно, да и получится сделать только в условиях теплицы. Дома же пользуются более простым способом – рассаживают стебелек с воздушными корнями. Он вырастает на цветоносе после завершения цветения. Будущее самостоятельное растение отделяют от основного, сажают в привычный для него субстрат и создают для комфорта необходимую влажность.Есть и третий способ – черенкование стебля цветоноса. Его разрезают на фрагменты так, чтобы в центре каждого осталась спящая почка. Затем черенки укладывают в контейнер с влажным мхом сфагнумом, а сверху затягивают целлофановым пакетом или пленкой. Вскоре почки прорастут и образуют деток — небольшие отростки, которые можно выращивать.Самый долгий способ размножения орхидей — выращивание деток на самом растении. Для этого «будят» спящую почку в температуре до 29 градусов. После этого около основания чешуи надрезают кору цветоноса. Почку оголяют при помощи пинцета и обрабатывают цитокиновой пастой для защиты от болезней, затем прикрывают кусочком сфагнума на месяц-полтора. За это время на месте почки образуется один или два «детеныша» с маленькими листами. Через три-четыре месяца у них появятся корешки. Как только они вырастут до двух сантиметров, деток нужно отрезать с куском материнского цветоноса и высадить в субстрат. Чтобы не пересохли, их можно закрыть пленкой.Вредители и заболеванияДомашняя орхидея может начать болеть из-за неправильного ухода. При недостатке тепла, света и влаги листья желтеют и вытягиваются. Пятна на них, а также мозаика на стволах появляются из-за вирусов, которые ничем не победить. Останется только выбросить растение вместе с горшком.Размягчившиеся листья и корни — работа бактерий. В таком случае нужно удалить пораженные места, обработать йодом и обсыпать углем. В запущенном виде — обработать купленным спецраствором с фунгицидами.Страдают орхидеи и от грибков. Для профилактики таких болезней необходимо проветривать помещение и избегать избыточной влажности, вытирать капли воды с листьев.Гнить растение начинает из-за нарушения температурного режима.
За это время на месте почки образуется один или два «детеныша» с маленькими листами. Через три-четыре месяца у них появятся корешки. Как только они вырастут до двух сантиметров, деток нужно отрезать с куском материнского цветоноса и высадить в субстрат. Чтобы не пересохли, их можно закрыть пленкой.Вредители и заболеванияДомашняя орхидея может начать болеть из-за неправильного ухода. При недостатке тепла, света и влаги листья желтеют и вытягиваются. Пятна на них, а также мозаика на стволах появляются из-за вирусов, которые ничем не победить. Останется только выбросить растение вместе с горшком.Размягчившиеся листья и корни — работа бактерий. В таком случае нужно удалить пораженные места, обработать йодом и обсыпать углем. В запущенном виде — обработать купленным спецраствором с фунгицидами.Страдают орхидеи и от грибков. Для профилактики таких болезней необходимо проветривать помещение и избегать избыточной влажности, вытирать капли воды с листьев.Гнить растение начинает из-за нарушения температурного режима. Чаще всего это возникает при парниковом эффекте.Поражают орхидею и насекомые — мошки, клещи, тля, щитовка, трипсы, блошки, мучнистый червец. Для избавления от них стоит приобрести специализированные препараты.Часто от мошек на растении помогает водка. 20 миллилитров спиртного напитка разбавляют одним литром воды и поливают раствором почву. Также водкой протирают и листья. Такая процедура помогает от клещей.- Орхидея, и правда, растение-алкоголик. Стоит добавить буквально 20 грамм водки в воду, и срезанные цветы будут стоять дольше. А вот сахар – это питательная среда для бактерий, которые будут убивать цветок. Аспирин же вообще неэффективен, — отмечает президент Ассоциации российских флористов Валентина Сафронова.
Чаще всего это возникает при парниковом эффекте.Поражают орхидею и насекомые — мошки, клещи, тля, щитовка, трипсы, блошки, мучнистый червец. Для избавления от них стоит приобрести специализированные препараты.Часто от мошек на растении помогает водка. 20 миллилитров спиртного напитка разбавляют одним литром воды и поливают раствором почву. Также водкой протирают и листья. Такая процедура помогает от клещей.- Орхидея, и правда, растение-алкоголик. Стоит добавить буквально 20 грамм водки в воду, и срезанные цветы будут стоять дольше. А вот сахар – это питательная среда для бактерий, которые будут убивать цветок. Аспирин же вообще неэффективен, — отмечает президент Ассоциации российских флористов Валентина Сафронова.
https://ria.ru/20201123/kitay-1585768536.html
https://radiosputnik.ria.ru/20201119/tsvetok-1585413711.html
https://radiosputnik.ria.ru/20201107/gortenziya-1583517332.html
https://radiosputnik.ria.ru/20200701/1573694157.html
https://radiosputnik.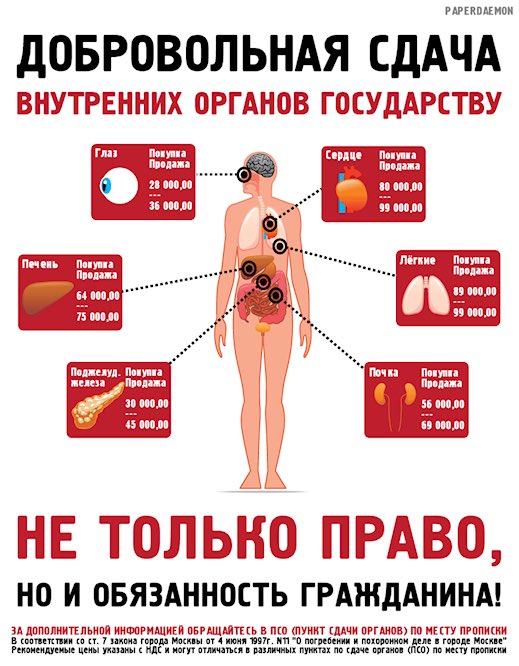 ria.ru/20200303/1566941828.html
ria.ru/20200303/1566941828.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/156091/43/1560914352_26:0:2757:2048_1920x0_80_0_0_00397a3d27f4798bb7ac24ab0eaaf3d0.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
в мире, растения, растениеводство, цветы
МОСКВА, 4 дек — РИА Новости. Орхидея – это тропический цветок, который в последние годы полюбился россиянам. Как ухаживать за растением в домашних условиях – в материале РИА Новости.По легенде, орхидея появилась на земле «из осколка радуги». Более 90% видов этого растения произрастают в тропическом климате Южной Америки. Но самый популярный комнатный цветок – орхидея фаленопсис – родом из Юго-Восточной Азии. С греческого название переводится как «похожий на бабочку».
23 ноября 2020, 00:01ТуризмВ Китае цветок научился прятаться от сборщиков трав— Декоративный тропический цветок орхидея фаленопсис больше всего подходит для оформления гостиной. А вот держать ее в спальне, особенно молодых людей или новобрачных, нежелательно. Считается, что именно этот цветок мешает молодым парам, — рассказала РИА Новости мастер-флорист Серафима Агеенко.
Особенности ухода за орхидеей
Освещенность
Несмотря на то, что фаленопсис считается самой неприхотливой из всех орхидей, он все равно требует соблюдения определенных правил в домашних условиях произрастания.
В солнечных субтропиках растение привыкло жить в полутени деревьев, потому в домах его лучше ставить на подоконниках, но без прямых солнечных лучей. Оно очень быстро привыкает к своему месту и не любит переездов даже на другой, настолько же освещенный, подоконник.
19 ноября 2020, 18:45
В Москве распустилось растение с дьявольским названиемТакже стоит учесть, что орхидее нужен прозрачный горшок. Ее корни должны получать свет, так как в природе они пребывают на воздухе — прикрепляются к коре деревьев, зарываются в мох. Кроме того, их не стоит полностью погружать в емкость. Можно частично оставить на поверхности.
Температурный режим
Комнатная орхидея будет комфортно себя чувствовать при температуре воздуха от 20 до 27 градусов в помещении днем, ночью от 14 до 24 градусов.
Полив и влажность воздуха
Этому растению требуется достаточно высокая влажность воздуха в доме, потому будет полезным поставить рядом с горшком аквариум, поддон или банку с водой или увлажнитель воздуха.
Активно поливать орхидею не стоит. Раза в неделю будет достаточно, иначе корни могут загнить. После полива они не должны оставаться в воде, поэтому не забывайте сливать ее из поддона.
7 ноября 2020, 14:30
Гортензия — как посадить и ухаживатьГортензия — это цветок семейства гортензиевых. Когда-то была только белая гортензия и красная, сейчас же существует уже гораздо больше сортов.Удобрение орхидеи
Существует два вида подкормки орхидей – внекорневая и корневая. Суть первой в опрыскивании раствором удобрения листьев, второй – в смачивании корней.
Перед периодом ожидаемого цветения лучше всего подкармливать растение удобрением с высоким содержанием калия и фосфора. Это обеспечит яркость и пышность бутонов и правильное развитие корневой системы.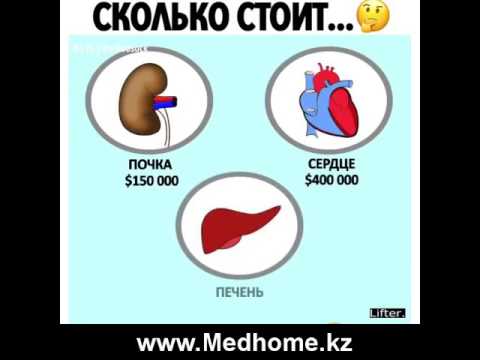 Применять подкормку следует примерно 4 раза с интервалом в две недели.
Применять подкормку следует примерно 4 раза с интервалом в две недели.
Если удобрения не применялись до цветения, то и после их использовать нельзя, так как из-за этого растение быстрее отцветет.
В момент отдыха орхидеи лучше давать ей удобрения с азотом. Он нужен для наращивания листовой массы. Определить недостаток азота можно по замедленному росту и мелким листовым пластинам. Дозировка подкормки рассчитывается в строгом соответствии с инструкцией на упаковке. Необходимо помнить, что орхидеи очень чувствительны к переизбытку азота и могут погибнуть даже из-за небольшого превышения концентрации.
Пересадка орхидеи в домашних условиях
Пересаживают растение по мере разрушения субстрата из коры сосны, мха сфагнума, торфа и угля. Через 2-3 года после покупки орхидеи корневая система успевает сильно разрастись в горшке, а сосновая кора превратиться почти в труху.
Начинать процесс «переезда» во время цветения нельзя. Лучше сделать это через две недели после того, как цветы опадут.
Пересадку орхидеи не любят, потому эту процедуру стоит повторять не чаще чем раз в 2-3 года.
Субстрат для растения можно приобрести в готовом виде в магазине. А при выборе нового прозрачного горшка стоит учесть, что он должен быть на 1-2 размера больше предыдущего.
Перед пересадкой орхидею необходимо полить, разбередить субстрат и аккуратно вынуть растение. Затем нужно промыть корни водой, удалить сгнившие части секатором. Срезы присыпать молотой корицей или углем.
После этого нужно дать орхидее просохнуть около шести часов, а по прошествии этого времени поместить в горшок, на дно которого уложен для устойчивости груз, например, небольшой камень. Корни растения нужно расправить, пустоты заполнить субстратом. Если некоторые корни не улеглись в горшок, оставьте их на поверхности. Затем стоит полить растение, чтобы кора просела.
Пересаженную орхидею оставляют в притененном месте на две недели, чтобы уберечь ее от излишнего света и перегрева.
1 июля 2020, 04:00Сказано в эфиреФлорист назвала лучшее растение для цветоводов-«чайников» Что делать, если очень хочется украсить квартиру растениями, а опыта ухода за ними нет? На этот вопрос ответила в интервью радио Sputnik президент Ассоциации российских флористов Валентина Сафронова.
Способы размножения в домашних условиях
Орхидею размножают после цветения при влажности примерно 80% и температуре около 30 градусов. При этом у растения не должно быть признаков заболевания.
Первый способ — размножить орхидею семенами. Однако это сложно, да и получится сделать только в условиях теплицы. Дома же пользуются более простым способом – рассаживают стебелек с воздушными корнями. Он вырастает на цветоносе после завершения цветения. Будущее самостоятельное растение отделяют от основного, сажают в привычный для него субстрат и создают для комфорта необходимую влажность.
Есть и третий способ – черенкование стебля цветоноса. Его разрезают на фрагменты так, чтобы в центре каждого осталась спящая почка. Затем черенки укладывают в контейнер с влажным мхом сфагнумом, а сверху затягивают целлофановым пакетом или пленкой. Вскоре почки прорастут и образуют деток — небольшие отростки, которые можно выращивать.
Самый долгий способ размножения орхидей — выращивание деток на самом растении. Для этого «будят» спящую почку в температуре до 29 градусов. После этого около основания чешуи надрезают кору цветоноса. Почку оголяют при помощи пинцета и обрабатывают цитокиновой пастой для защиты от болезней, затем прикрывают кусочком сфагнума на месяц-полтора. За это время на месте почки образуется один или два «детеныша» с маленькими листами. Через три-четыре месяца у них появятся корешки. Как только они вырастут до двух сантиметров, деток нужно отрезать с куском материнского цветоноса и высадить в субстрат. Чтобы не пересохли, их можно закрыть пленкой.
Для этого «будят» спящую почку в температуре до 29 градусов. После этого около основания чешуи надрезают кору цветоноса. Почку оголяют при помощи пинцета и обрабатывают цитокиновой пастой для защиты от болезней, затем прикрывают кусочком сфагнума на месяц-полтора. За это время на месте почки образуется один или два «детеныша» с маленькими листами. Через три-четыре месяца у них появятся корешки. Как только они вырастут до двух сантиметров, деток нужно отрезать с куском материнского цветоноса и высадить в субстрат. Чтобы не пересохли, их можно закрыть пленкой.
Вредители и заболевания
Домашняя орхидея может начать болеть из-за неправильного ухода. При недостатке тепла, света и влаги листья желтеют и вытягиваются. Пятна на них, а также мозаика на стволах появляются из-за вирусов, которые ничем не победить. Останется только выбросить растение вместе с горшком.
Размягчившиеся листья и корни — работа бактерий. В таком случае нужно удалить пораженные места, обработать йодом и обсыпать углем. В запущенном виде — обработать купленным спецраствором с фунгицидами.
В запущенном виде — обработать купленным спецраствором с фунгицидами.
Страдают орхидеи и от грибков. Для профилактики таких болезней необходимо проветривать помещение и избегать избыточной влажности, вытирать капли воды с листьев.
Гнить растение начинает из-за нарушения температурного режима. Чаще всего это возникает при парниковом эффекте.
Поражают орхидею и насекомые — мошки, клещи, тля, щитовка, трипсы, блошки, мучнистый червец. Для избавления от них стоит приобрести специализированные препараты.Часто от мошек на растении помогает водка. 20 миллилитров спиртного напитка разбавляют одним литром воды и поливают раствором почву. Также водкой протирают и листья. Такая процедура помогает от клещей.
— Орхидея, и правда, растение-алкоголик. Стоит добавить буквально 20 грамм водки в воду, и срезанные цветы будут стоять дольше. А вот сахар – это питательная среда для бактерий, которые будут убивать цветок. Аспирин же вообще неэффективен, — отмечает президент Ассоциации российских флористов Валентина Сафронова.
Должно ли правительство США платить людям за их почки? Настали тяжелые времена для оптимистов в области здравоохранения. Эта печальная правда проявилась более ясно на прошлой неделе, когда я готовил планы уроков для курса стратегии здравоохранения, который я преподаю в Стэнфордской высшей школе бизнеса. На первом занятии семестра я предлагаю краткое изложение успехов системы здравоохранения за предыдущий год.В этом году выбор был невелик: новые разработки в области искусственного интеллекта и успехи Haven, широко обсуждаемого предприятия Amazon-Berkshire-Chase, дали некоторые проблески. Однако основная часть движения в отрасли шла в неправильном направлении. Десятки скандалов, от фиксации цен на непатентованные лекарства до серьезных конфликтов интересов, коснулись некоторых крупнейших игроков в сфере здравоохранения. Что еще более обескураживает, не было никаких конкретных доказательств того, что медицинское обслуживание в США стало более доступным, доступным, более удобным или лучшим (если судить по качественным результатам) с этого времени в прошлом году. Желая внести луч оптимизма и разжечь возможность позитивных изменений, я задумался над следующим вопросом. Что реально может сделать наша страна для улучшения здоровья пациентов и сокращения медицинских расходов в следующем году? Поскольку ключевое слово было «реалистично», на этот вопрос было трудно ответить. Конгресс может ограничить цены на лекарства или легализовать импорт эффективных биоподобных препаратов, таких как инсулин. Но насколько вероятно любое действие, учитывая, что фармацевтическая промышленность ежегодно тратит сотни миллионов на то, чтобы повлиять на законодательство? А как насчет устаревших платформ информационных технологий в здравоохранении? Шесть из 10 врачей считают, что электронные медицинские карты (ЭМК) нуждаются в полной переработке. Одно решение: платить людям за почки Идея платить людям за их органы не нова, но в настоящее время она незаконна. Еще в 1984 году Национальный закон о трансплантации органов (NOTA) объявил покупку и продажу человеческих органов вне закона. До того, как правительство США занялось транспортировкой и трансплантацией органов, один врач в Вирджинии попытался создать компанию для прямой коммерческой покупки и продажи почек.И поскольку не было никаких законов, чтобы остановить его, NOTA имела смысл. Сегодня это не так. Мы должны позволить государству покупать почки и продолжать использовать независимое агентство, чтобы решать, каким именно людям следует получить эти органы. Чтобы понять, почему это решение имеет смысл сейчас, полезно посмотреть, как далеко мы продвинулись за последние 35 лет. В 1980-х годах трансплантация была неточной наукой и часто была опасной. На момент подписания закона NOTA только 80% реципиентов почечного трансплантата пережили операцию и связанную с ней иммуносупрессию.Сегодня показатели успешности трансплантации среди опытных хирургов и бригад трансплантологов превышают 95%. Еще в 80-е годы отсутствие диагностических тестов на инфекционные заболевания, такие как СПИД и гепатит, вызывало опасения, что люди могут лгать о своем состоянии здоровья, чтобы продать орган, тем самым увеличивая риск передачи заболеваний для реципиентов органов. Наконец, сторонники NOTA почувствовали этическое обязательство поддерживать доброжелательность к донорству органов. Они не хотели, чтобы его запятнали те, кто ищет личной, финансовой выгоды.В 1983 году д-р Дэвид А. Огден, президент Национального фонда почек, сказал The New York Times : «Аморально и неэтично подвергать живого человека риску хирургических осложнений и даже смерти за денежные выплаты. С развитием науки и общества, NOTA необходимо модернизировать для 21 века. Мы можем реально спасти десятки тысяч жизней и миллиарды долларов, если бы программе Medicare было разрешено покупать почки для соответствующих реципиентов и если бы она оплачивала трансплантацию, а не диализ. Чтобы подчеркнуть преимущества этого подхода, стоит рассмотреть два набора чисел. Первый набор касается несоответствия между потребностью в почках и доступностью, любезно предоставлен «Проектом почек» Калифорнийского университета в Сан-Франциско (UCSF):
Другой важный набор чисел, также от UCSF, является финансовым:
Вооружившись этими цифрами, давайте посчитаем, сколько денег можно будет сэкономить, если снабдить 100 000 человек из списка по пересадке почки новыми почками по сравнению с сохранением примерно 100 000 человек на диализе. Зная, что ежегодные расходы на диализ для этой группы населения составляют 89 000 долларов на пациента, общие расходы для всех 100 000 человек в течение следующих пяти лет составят 44,5 миллиарда долларов. Расходы для того же населения на получение новых почек составят 32 000 долларов на саму процедуру плюс 25 000 долларов на послеоперационный уход ежегодно, что за тот же пятилетний период составит 15,7 миллиарда долларов. Это экономия почти 25 миллиардов долларов. Конечно, последние расчеты предполагают, что мы сможем найти 100 000 новых доноров почек. Чтобы найти 100 000 доноров, правительство США могло предложить заплатить 50 000 долларов за почку (плюс все хирургические расходы и расходы на последующее лечение) примерно на 5 миллиардов долларов. Это не только улучшит здоровье и продолжительность жизни получателей, но и приведет к общей экономии на здравоохранении в размере 20 миллиардов долларов в течение следующих пяти лет. Сэкономленные средства затем можно было бы использовать для финансирования программ, которые улучшают медицинскую профилактику, помогают управлять проблемой высокого кровяного давления в стране и снижают уровень заболеваемости диабетом у взрослых — все это будет иметь большое значение для предотвращения заболеваний почек и снижения будущих затрат на здравоохранение. . Итак, если это предложение может улучшить здоровье американцев, снизить медицинские расходы и профинансировать будущие программы, чтобы помочь большему количеству американцев избежать почечной недостаточности, каковы потенциальные ловушки? Некоторые говорят, что легализация продажи органов приведет к тому, что богатые воспользуются бедными. Другие опасаются, что изменение NOTA приведет к появлению черного рынка. Фактически, реализация этого предложения устранит необходимость в черном рынке, поскольку органы будут легко доступны и контролироваться федеральным агентством. Есть также опасения, что люди с низким доходом будут вынуждены под воздействием экономических факторов жертвовать почки в ущерб своему здоровью.Здесь тоже аргумент правдоподобен. Наука доказала, что оставшийся у донора орган компенсирует потерю. После удаления двойная почка увеличивается и становится такой же эффективной, как когда их было две. Кроме того, наука освоила скрининг на инфекционные заболевания, что вызывало исторические опасения, что бедные люди могут лгать о своих существующих болезнях за деньги доноров, как устаревшие, так и культурно нечувствительные. Наконец, как насчет риска потери донором оставшейся почки из-за травмы или рака? В настоящее время люди, которые анонимно жертвуют почки, автоматически помещаются в начало списка трансплантатов, если они им понадобятся в будущем.Если дать такое же обещание платным донорам, небольшой риск, связанный с наличием единственной почки, будет компенсирован уверенностью в получении немедленного доступа к трансплантации, если это окажется необходимым. Не существует серебряной пули для разрешения кризиса в области здравоохранения в нашей стране, и каждое решение имеет свои риски и недостатки. Использование денег для стимулирования донорства почек несет в себе определенные опасности, но также и огромную выгоду. Те, кто готов сделать пожертвование, заработают 50 000 долларов, что будет иметь большое значение для учебы в колледже, дома или других семейных расходов.А те, кто получит органы, будут жить лучше и продуктивнее. Это реальное решение. И, если все сделано хорошо, самая большая проблема программы может заключаться в том, чтобы отказать потенциальным донорам из-за народного спроса. Я с нетерпением жду, что студенты думают об этой идее в сентябре. И, пожалуйста, поделитесь со мной своими мыслями в Twitter и LinkedIn. 10 вещей, которые ваш врач не скажет вам о трансплантацииЕсли вы или ваш любимый человек столкнулись с органной недостаточностью, вам нужно знать все, что вы можете, о сложностях донорства и трансплантации — будь то новая почка или что-то еще редко — трансплантация печени, сердца, поджелудочной железы, легких или кишечника.Ваш новый орган может быть получен от живого донора. Кроме того, оно может исходить от человека, который договорился пожертвовать свои органы после смерти. Сегодня 165 миллионов жителей США подписаны в качестве доноров органов в случае их смерти, отмечает OrganDonor.gov, и один человек может пожертвовать до восьми жизненно важных органов: сердце, два легких, печень, поджелудочная железа, две почки и кишечник. СВЯЗАННЫЙ: Молодые чернокожие взрослые с гораздо более высоким риском смерти после трансплантации сердца Если вы находитесь в списке ожидания или собираетесь сдать кровь, вот что вам нужно знать о трансплантации органов. Хотя трансплантация здорового органа для замены больного или неисправного органа может продлить жизнь, трансплантаты имеют ограничения. По данным Медицинского центра Векснера при Университете штата Огайо, срок жизни трансплантированной почки составляет в среднем от 10 до 13 лет, если орган был получен от живого донора, и от семи до девяти лет, если он был от умершего донора. Между тем, у 75 процентов реципиентов печень будет функционировать в течение пяти и более лет. После трансплантации сердца средняя выживаемость органа составляет 12.5 лет. Пересаженная поджелудочная железа продолжает работать около 11 лет в сочетании с трансплантацией почки. И трансплантированное легкое продолжает работать в среднем около пяти лет, но это увеличивается до восьми лет, если были пересажены оба легких, отмечает OSU. 2. Пересаженный орган может переносить скрытое заболевание вместе с ним Перед трансплантацией органы проверяются на общие инфекции и болезни. Вирус Западного Нила и бешенство — два примера инфекционных заболеваний, которые передавались через трансплантацию органов, как показывают данные CDC, и Классен добавляет, что также были зарегистрированы редкие случаи рака при трансплантации.И, как сообщал NBC News, пациент с трансплантатом органа заразился COVID-19 из легких донора, у которого изначально был отрицательный результат на вирус и не было никаких симптомов болезни. Врачи могут быть полностью осведомлены об инфекции в органе еще до того, как его назначат для трансплантации. СВЯЗАННЫЙ: Признаки и симптомы гепатита C 3. Финансовые затраты на пожертвование органа могут быть выше, чем вы думаете Предложение пожертвовать почку или часть вашей печени для жизни донор может помочь спасти жизнь, но этот процесс может обойтись удивительно высокими затратами. Пожертвование органа может означать потерю заработной платы из-за отсутствия на работе, дорожных расходов на операцию и перерыва для восстановления — и, по данным Национального фонда почек, ни Medicare, ни страховка не покрывают эти расходы.По оценкам, живые доноры почек в Соединенных Штатах несут наличные расходы, связанные с трансплантацией, в среднем в размере 5000 долларов США и до 20 000 долларов США, согласно прошлому отчету. Но, по данным Национального фонда почек, живому донору не нужно платить за что-либо, связанное с фактической операцией по трансплантации. Национальная программа помощи живым донорам и другие подобные программы могут помочь покрыть некоторые расходы, связанные с пожертвованиями. Кроме того, живые доноры могут иметь право на отпуск по болезни и инвалидность штата в соответствии с федеральным законом о семейном медицинском отпуске, также отмечает Национальный фонд почек, в то время как федеральные служащие, некоторые служащие штата и некоторые другие работники могут иметь право на 30-дневный оплачиваемый отпуск. 4. Донорство живого органа может стоить вам страховки жизни Неожиданным последствием донорства органа в качестве живого донора является изменение вашего права на страховое покрытие. Несмотря на то, что Закон о доступном медицинском обслуживании гарантирует, что вам не может быть отказано в медицинском страховании из-за наличия ранее существовавшего заболевания, Национальный фонд почек отмечает, что некоторые живые доноры сообщают, что им трудно найти страховку жизни или им приходится платить более высокие страховые взносы. В таких случаях центр трансплантологии может обратиться в страховую компанию, чтобы сообщить им, что как живой донор вы не подвержены повышенному риску смерти из-за донорства. Вы также можете получить страхование жизни через Сеть доноров живых органов, которая позволяет донорам покупать страховку жизни и инвалидности на случай, если у них действительно возникнут осложнения после пожертвования органа. СВЯЗАННЫЕ С: 9 вопросов, на которые вы должны быть способны ответить о своей печени 5.Трансплантационный туризм может быть опасным для вашего здоровья и несправедливым для доноров органов Согласно данным юридического факультета Корнельского университета, закон США запрещает платить людям за донорство органов. Всемирная организация здравоохранения (ВОЗ) отмечает, что покупка и продажа органов для трансплантации от живых доноров запрещены во многих странах, но отсутствие доступных донорских органов во всем мире привело к международной торговле органами. В исследовании, опубликованном в июне 2017 года в журнале PLoS One , отмечалось, что туризм по трансплантации органов составляет 10 процентов мировых операций по пересадке органов и быстро растет за последние 20 лет. Исследователи внимательно изучили Тайвань и сравнили граждан, которым была сделана трансплантация почек и печени внутри страны, с гражданами за рубежом. Они обнаружили, что у зарубежной группы были более низкие показатели здоровья — например, пятилетняя выживаемость после трансплантации печени в домашних условиях составила 79.5 процентов, а за рубежом — всего 54,7 процента. По данным Сети по закупке и транспортировке органов (OPTN), в настоящее время в очереди на трансплантацию печени находится почти 11 900 человек. Соединенные Штаты. По данным OPTN, в 2020 году только 8906 американцев получили трансплантацию печени. По данным клиники Кливленда, одной из основных причин печеночной недостаточности в США является гепатит С.Но если вам сделают пересадку печени, новая, здоровая печень может заразиться гепатитом С, попав в ваш организм. Это связано с тем, что вирус гепатита С может продолжать циркулировать в крови по всему телу, включая печень. Тем не менее, поскольку гепатит С теперь излечим, большинство людей лечатся до трансплантации, говорит Классен. По данным ВОЗ, противовирусные препараты могут вылечить более 95 процентов людей, инфицированных гепатитом С. Эти новые лекарства являются дорогостоящими при оплате из кармана, но покрываются большинством планов медицинского страхования, как отмечается в документе, опубликованном в декабре 2019 года в Американском журнале управляемой помощи (American Journal of Managed Care ). СВЯЗАННЫЙ: Что нужно знать, если вам нужна трансплантация печени от гепатита C 7. Пересадка почки может быть реальным вариантом для вас, если у вас почечная недостаточностьЕсли ваши почки не работают, ваши Согласно Penn Medicine, врач должен обсудить с вами вариант трансплантации почки, прежде чем вы начнете диализ. Но одно прошлое исследование показало, что треть опрошенных диализных пациентов сказали, что они не знали о варианте трансплантации.Насколько помнят пациенты, этого важного обсуждения трансплантации почки так и не произошло. Поскольку исследование показало, что люди, проинформированные о варианте трансплантации, почти в три раза чаще его используют, не забудьте спросить обо всех возможных вариантах, включая трансплантацию. Тем не менее, сделать превентивную трансплантацию перед диализом непросто, говорит Классен, если у вас нет живого донора, который хочет пожертвовать вам свою почку: «Обычно из-за необходимости ждать донорства большинство люди должны находиться на диализе в течение определенного периода времени, прежде чем произойдет трансплантация. Хотя женщины чаще являются живыми донорами, чем мужчины, они реже мужчин становятся реципиентами живые донорские почки, согласно отчету, опубликованному в октябре 2017 года в журнале Американского общества нефрологов (JASN). В Соединенных Штатах, например, женщины составляли 37 процентов реципиентов почек от живых доноров, в то время как они составляли 63 процента от живых доноров почек, подчеркивается в отчете . Итак, что дает? Одна из причин несоответствия является биологической: «При пересадке почки ограничивающим фактором для женщин является то, что после рождения детей их иммунная система становится более чувствительной, что затрудняет поиск пары», — объясняет Классен. В отчете JASN также указывается, что, несмотря на то, что в наши дни иммунная память рассматривается как преимущество (особенно во время пандемии COVID-19), получение совпадения с трансплантатом становится еще сложнее из-за повышенного риска отторжения. К счастью, отмечает Классен, система сопоставления дает людям с высокочувствительной иммунной системой повышение в рейтинге. В отчете за март 2018 года в журнале Trends in Immunology отмечается, что определенные методы лечения, нацеленные на рецепторы гормонов, могут помочь компенсировать разницу между мужчинами и женщинами в будущем. СВЯЗАННЫЙ: Дивный новый мир женского здоровья Техника: что вскружило голову на выставке CES 2020 9. Ваш вес может повлиять на то, можете ли вы получить трансплантат Когда вы встречаетесь с врачом или трансплантатом центр, вам могут посоветовать снизить индекс массы тела (ИМТ) до 30 или меньше.Хотя ИМТ ошибочен и не является точным показателем здоровья для всех, в этом случае целевой ИМТ будет соответствовать менее 203 фунтам для человека ростом 5 футов 9 дюймов, согласно калькулятору ИМТ Национального института здравоохранения. . Рассуждения? Национальный фонд почек отмечает, что индекс массы тела 30 или выше является признаком ожирения, которое подвергает человека большему риску плохого заживления ран, инфекции и отторжения почек. Просто знайте, что целью должен быть здоровый подход к снижению веса — и важно встретиться с зарегистрированным диетологом-диетологом, чтобы вы не упустили ключевые питательные вещества и не сделали ничего экстремального, которое может поставить под угрозу ваше здоровье. Национальный фонд почек; Ваш врач также может обсудить с вами операцию по снижению веса. 10. Где вы живете, можно определить, как долго вам придется ждатьВремя ожидания органа может варьироваться от дней до лет, и врачи не могут предсказать время для каждого отдельного случая.Среднее время ожидания трансплантации почки, например, составляет 3,6 года по данным OrganDonor.gov, но все зависит от того, когда орган станет доступным и подходит ли он для вашей группы крови и вашего тела. Время ожидания также может зависеть от того, где вы живете, как показывают данные, опубликованные в июне 2018 года в American Journal of Transplantation . Прошлые исследования также показали, что в Соединенных Штатах у людей, живущих на юго-востоке страны, самый высокий уровень терминальной стадии почечной недостаточности и самый долгий период ожидания трансплантации почки, в то время как другие исследования показали, что у людей, живущих в Новой Англии, самый короткий период времени. время ожидания трансплантации почек.Исследователи указывают на нехватку кадров и потребность в дополнительном обучении поставщиков и пациентов трансплантологии как некоторых из факторов, которые могут повысить показатели. Тем не менее, есть хорошие новости: «Новая система распределения почек появится позже в 2021 году, и одна из новых функций [этой системы] поможет уменьшить географическое неравенство», — говорит Классен. Донорство почки | CignaОбзор темы Трансплантация почки — лучший известный способ спасти жизнь человека после того, как у него или нее разовьется почечная недостаточность. Кто может стать донором почки?Живого донора:
Что мне нужно сделать, чтобы стать донором почки? Если вы решите стать донором почки, для анализа будут взяты образцы вашей крови, включая вашу группу крови и другую генетическую информацию (которая может включать тип HLA), чтобы увидеть, насколько хорошо вы соответствуете реципиенту. Если ваши анализы крови хорошие, вы встретитесь с социальными работниками в трансплантологическом учреждении, чтобы обсудить другие обязанности. Вам будет предоставлена информация, например, сколько времени вам нужно будет отдохнуть от работы, подробности операции и процесса восстановления, которая поможет вам принять обоснованное решение. Ваши встречи с командой социальных работников будут строго конфиденциальными. Когда я встречусь с врачом?После того, как вы решили стать донором почки и стали известны результаты вашего перекрестного сопоставления, вы будете обследованы врачом, обычно нефрологом.Ваша оценка начнется с истории болезни и медицинского осмотра. Вам будет предложен ряд лабораторных анализов для проверки функции почек, включая химический анализ, анализ мочи и анализы мочи на белок. Вы также можете пройти компьютерную томографию почек, чтобы оценить состояние почек, мочевыводящих путей и других структур в тазу. Что включает в себя операция по пересадке почки?Перед операцией вам сделают общий наркоз. До недавнего времени для удаления почки требовалось 8 дюймов.Разрез от 20,3 см до 22,9 см на одной стороне тела (бок). Сейчас для удаления донорской почки обычно используют лапароскопию. Преимущества лапароскопического удаления почки включают меньшую боль, более короткое пребывание в больнице, более быстрое возвращение к нормальной деятельности и меньший, менее заметный рубец. Каковы риски стать донором почки?Удаление почки из вашего тела требует серьезного хирургического вмешательства. Существует риск осложнений после операции, таких как боль, инфекция, пневмония и кровотечение. Человек может жить только с одной здоровой почкой. Но врачи узнают, что донорство почки может увеличить вероятность определенных проблем со здоровьем через годы после донорства. Проводятся дополнительные исследования, чтобы лучше понять долгосрочные риски. Пожертвование органа может повлиять на вас и вашу семью. Речь идет о многих эмоциональных проблемах. Могут возникнуть такие расходы, как дорожные расходы и потеря заработной платы. Кроме того, донорство органов может повлиять на ваше страховое покрытие. Если вы подумываете о донорстве почки, ваша медицинская бригада поможет вам разобраться в плюсах и минусах, чтобы вы могли принять правильное решение. Какие у меня будут ограничения после того, как я пожертвую почку?Донорство почки не повлечет за собой каких-либо ограничений в вашей обычной повседневной деятельности. После выздоровления после операции вы сможете возобновить все свои обычные занятия, включая упражнения и занятия спортом. Донорство почки не влияет на фертильность человека. Например, это не повлияет на способность женщины забеременеть или способность мужчины оплодотворить женщину. Но если женщина пожертвовала почку, ее риск преэклампсии или высокого кровяного давления во время беременности может быть выше. Кто оплачивает мои больничные расходы?В Соединенных Штатах ваши медицинские расходы будут покрываться медицинской страховкой получателя. Большинство страховых компаний покрывают 100% медицинских расходов на трансплантацию, включая предтрансплантационные обследования и лабораторные анализы.Если у получателя нет медицинской страховки, ваши медицинские расходы будут покрываться Medicare. Дополнительная информацияДополнительную информацию о том, как стать донором почки, см .:
Основы хронической болезни почек | Инициатива по хронической болезни почекВаши почки, каждая размером с компьютерную мышь, фильтруют всю кровь в вашем теле каждые 30 минут. Они усердно работают над удалением шлаков, токсинов и лишней жидкости. Они также помогают контролировать кровяное давление, стимулируют выработку красных кровяных телец, поддерживают здоровье костей и регулируют химические вещества в крови, которые необходимы для жизни. Правильно функционирующие почки имеют решающее значение для поддержания хорошего здоровья, однако, по оценкам, более одного из семи взрослых американцев страдают хронической болезнью почек (ХБП). О хронической болезни почекХБП — это состояние, при котором почки повреждены и не могут фильтровать кровь так, как должны. Из-за этого избыточная жидкость и отходы крови остаются в организме и могут вызвать другие проблемы со здоровьем, такие как сердечные заболевания и инсульт. Более 1 из 7 По оценкам, 15% взрослого населения США страдают хроническим заболеванием почек, то есть около 37 миллионов человек. Некоторые другие последствия ХБП для здоровья включают:
ХБП имеет разную степень серьезности.Обычно со временем состояние ухудшается, хотя было показано, что лечение замедляет прогрессирование. Если не лечить, ХБП может прогрессировать до почечной недостаточности и ранних сердечно-сосудистых заболеваний. Когда почки перестают работать, для выживания необходим диализ или трансплантация почки. Почечная недостаточность, которую лечат диализом или трансплантацией почки, называется терминальной стадией почечной недостаточности (ТПН). Узнайте больше о ESRD. Не все пациенты с заболеванием почек прогрессируют до почечной недостаточности. Чтобы предотвратить ХБП и снизить риск почечной недостаточности, контролируйте факторы риска ХБП, ежегодно проходите тестирование, меняйте образ жизни, принимайте лекарства по мере необходимости и регулярно посещайте свою медицинскую бригаду.
Глобальные почечные цепочки | PNASЗначениеПочечная недостаточность является одной из ведущих причин смерти во всем мире, и лучшим лечением является трансплантация. Однако трансплантатов не хватает из-за нехватки пересаживаемых органов и финансовых средств. В Соединенных Штатах и некоторых других странах цепочки обмена почек появились как способ увеличить количество трансплантатов; пациенты, у которых есть желающий донор, но не могут получить почку этого донора, могут получить совместимую почку от предполагаемого донора другого пациента.Такие программы намного лучше развиты в границах богатых стран, что мало помогает пациентам в странах с ограниченной трансплантацией или обменом почки. В этой статье предлагается и анализируется способ расширения цепочки обмена почек для распространения преимуществ во всем мире. AbstractПочечная недостаточность — всемирное бедствие, которое становится еще более опасным из-за нехватки трансплантатов. Мы предлагаем способ организации цепочек обмена почками на международном уровне между странами со средним уровнем дохода, имеющими финансовые препятствия для трансплантации, и странами с высоким уровнем дохода, где многие пациенты и пары пациент-донор сталкиваются с длительным сроком проведения диализа.Предложение включает цепочки обмена, которые начинаются в стране со средним уровнем дохода и заканчиваются в стране с высоким уровнем дохода. Мы также предлагаем способ финансирования таких сетей за счет экономии средств плательщикам здравоохранения США. Трансплантация является методом выбора при почечной недостаточности, но многие препятствия мешают трансплантации. Барьеры в экономически развитых странах отличаются от барьеров в развивающихся странах, но трансплантация крайне недооценена по сравнению с частотой почечной недостаточности как в более богатых, так и в более бедных странах. В большинстве развивающихся стран трансплантация или другое лечение, такое как диализ, в основном недоступны из-за финансовых ограничений, а почечная недостаточность является смертным приговором (1–4). В развитом мире многие люди борются с диализом, временным лечением, терпя долгое ожидание трансплантации, и многие тысячи людей умирают каждый год в ожидании из-за нехватки трансплантируемых органов. * В этой статье рассматривается, как эти две проблемы — отсутствие доступа к трансплантации или диализу и нехватки трансплантируемых органов — каждое из них может помочь облегчить действие другого. Обмен почки, который стал стандартной формой трансплантации в Соединенных Штатах и расширяется в других странах, может увеличить количество трансплантатов, доступных от добровольных живых доноров, которые в противном случае не смогли бы реализовать свое желание пожертвовать почку, путем организации обменов, при которых пациент в каждой паре пациент-донор получает совместимую почку от донора другого пациента (например, ссылки 5⇓ – 7). Емкость обмена почек неуклонно увеличивалась, поскольку дизайн обмена вырос от простого обмена между парами, чтобы включить более крупные циклы обмена (8, 9) и цепочки трансплантации, начатые ненаправленным донором (например,г., исх. 10⇓⇓⇓⇓ – 15; динамика цепей изучена в [1]. 16⇓ – 18). Цепочки могут включать в себя множество пар пациент-донор. Двумя факторами, ограничивающими рост обмена почек в США, Европе и других странах, являются нехватка доноров группы крови O и высокая чувствительность многих пациентов (т. Е. У них выработались антитела ко многим человеческим белкам, поэтому им необходимо очень большой пул обмена почек, чтобы иметь хорошие шансы найти пару, с которой они могут обменяться совместимой почкой). Недавнее предложение, называемое глобальным обменом почек (GKE), предусматривает, что организации здравоохранения США приглашают иностранных пациентов с финансовыми ограничениями, у которых есть желающие доноры, участвовать в американском обмене почек, как это делают американские пациенты, бесплатно (19, 20).Пары пациент-донор, чей барьер для трансплантации является финансовым, сами по себе могут быть несложными, а это означает, что им легче найти пары, которые трудно подобрать, которым иначе было бы трудно найти совпадение (21). Медицинское лечение (включая всю до- и послеоперационную помощь иностранному пациенту и донору) может быть профинансировано за счет сбережений американской системы здравоохранения, когда пациенту трансплантируют и (таким образом) прекращают диализ, что является гораздо более дорогостоящим лечением. (То, что диализ намного дороже трансплантации, является ключом к жизнеспособности GKE, в котором сбережения от сокращения диализа для американских пациентов, которым в противном случае пришлось бы столкнуться с длительным диализом, могут покрыть уход за иностранными парами пациент-донор, с которыми они совместимы.) Хотя GKE получил значительную поддержку (22–24), он также вызвал критику и опровержение (например, ссылки 25–32). Одна из первых критических замечаний заключалась в том, что GKE каким-то образом нарушил законы, запрещающие платить донорам за их почки. Этот аргумент был эффективно опровергнут, среди прочего, Комитетом Европейского общества трансплантологии по этическим, правовым и психосоциальным аспектам трансплантации (24), который заметил, что выплаты в GKE по существу не отличаются от платежей при обмене почки внутри страны. .В каждом случае платежи поступают от плательщиков медицинских услуг в больницы за медицинские услуги, а каждая пара пациент-донор жертвует почку без финансовой компенсации. † Два критических замечания до сих пор не были решены напрямую через дизайн глобальных бирж (сравните ссылку 34). Во-первых, трансплантация иностранных пациентов в Соединенных Штатах не увеличивает количество трансплантаций, выполняемых больницами в их родных странах. Вторая связанная критика заключается в том, что, когда пары иностранный пациент-донор участвуют в американских цепочках обмена почки, пересаживается больше американских пациентов, чем иностранных, и это может показаться несправедливым (а воспринимаемое неравенство может способствовать воспринимаемому отталкиванию транзакции [сравните исх.35]). В этой статье предлагается дизайн глобальных почечных цепей (GKC), которые позволят устранить эту критику путем построения цепочек обмена почек, которые берут начало в стране с современными возможностями трансплантации, но с финансовыми препятствиями для трансплантации. Иностранный ненаправленный донор мог начать цепочку обмена почки в чужой стране (которая не могла быть профинансирована другим способом), при этом донор последней пары в иностранной цепочке (донор-мост) делал пожертвование американцу. Затраты, необходимые для покрытия расходов на иностранных пациентов и доноров (дома и в Соединенных Штатах), будут оплачиваться за счет сбережений американской системы здравоохранения от трансплантации американских пациентов, которые в противном случае остались бы на диализе. На практике несколько зарубежных трансплантатов можно было бы профинансировать, начав длинную цепочку трансплантаций с ненаправленным донором в иностранном регионе, с донором моста, путешествующим в Соединенные Штаты, чтобы продолжить цепочку, которая будет включать несколько трудно сопоставимых американских пациентов и завершается пожертвованием пациенту из списка ожидания умерших доноров в США. Требуется некоторый финансовый инжиниринг, чтобы эта программа стала самофинансируемой. Деньги, сэкономленные при трансплантации американца (или гражданина другой страны с высоким уровнем дохода), экономятся на диализе, в то время как дополнительные расходы будут понесены в центрах трансплантации в другой стране и (для донора, который путешествует) в Соединенных Штатах (в в странах с системой здравоохранения с одним плательщиком это может быть осуществимо проще, чем в Соединенных Штатах, при условии, что экономия превышает затраты, которые в противном случае были бы понесены, поскольку экономия и затраты происходят из одного и того же бюджета).Поскольку такая программа сократит время ожидания трансплантата, она также снизит затраты на диализ, и нам необходимо показать, что экономия США на диализе остается достаточной для финансирования дополнительных трансплантаций за рубежом, даже когда программа работает в очень больших масштабах. доступ получают как можно больше пациентов и пар пациент-донор в странах с высоким и средним уровнем доходов. Американская система здравоохранения обеспокоена тем, что потребуются законодательные изменения, чтобы позволить Medicare (которая оплачивает очень большую долю затрат на диализ) финансировать трансплантацию иностранных пациентов, несмотря на экономию, которую Medicare получит благодаря более ранней трансплантации Американцы.Фундаментальные законодательные изменения относительно легко представить и отстаивать, но их сложно реализовать. ‡ Вместо этого мы предлагаем финансовую схему, которая может быть реализована в Соединенных Штатах без дополнительного законодательства. Частные страховые компании в США несут ответственность за оплату первых 33 месяцев диализа своих пациентов, при этом Medicare активируется только после этого (https://www.medicarerights.org/guest-posts/2016/09/27/blog- почечная недостаточность-медицина-знаю).Поскольку трансплантация значительно дешевле, чем 33 месяца диализа (а среднее время диализа значительно больше), страховые компании § и самостраховавшие американские компании также получают экономию от оперативной трансплантации, достаточную для оплаты дополнительных трансплантатов. Мы предлагаем оплачивать расходы на иностранных пациентов из этой суммы сбережений. Эта экономия является наибольшей для пациентов, которые находились на диализе в течение кратчайшего времени, и поэтому заключительная часть предлагаемого нами дизайна состоит в том, что очередь для этих американских пациентов на пересадку почки живого донора от донора мостовидного протеза будет иметь приблизительная дисциплина очереди «последний пришел — первый ушел» (LIFO).Это будет важно для сохранения значительной экономии даже тогда, когда GKC работает в масштабе, который существенно сокращает среднее время диализа. ¶ GKC, таким образом, включают в себя три нетрадиционных конструктивных элемента: трансграничные цепочки обмена почек, финансирование частными плательщиками (например, консорциумы самострахованных компаний) и дисциплину порядка LIFO. Обратите внимание, что политика таких организаций, как Всемирная организация здравоохранения, заключается в том, чтобы рекомендовать странам обеспечить самодостаточность в трансплантации.Однако ни одна страна еще не сделала этого; даже в самых богатых странах больше пациентов, нуждающихся в трансплантации, чем трансплантируемых органов. Кроме того, для стран со средним уровнем дохода, которые не могут финансировать трансплантацию для всех своих граждан, которые в ней нуждаются, эта рекомендация самодостаточности — это просто совет подождать, пока страна станет богатой, что является эффективным смертным приговором для их современных пациентов, которые не могут быть обрабатывали. В данном документе вместо этого рассматривается, как мы могли бы попытаться улучшить эту глобальную проблему здравоохранения с помощью глобального решения. Модель с короткими цепямиМодель, которую мы представим, предназначена для представления простой минимальной реализации GKC с самой короткой боковой цепью в США, включающей один трансплантат в США, и, следовательно, с наименьшей экономией в США. В частности, цепочка обмена почек начинается в чужом месте. Донор из последней пары пациент-донор (то есть донор-мост) отправляется в Соединенные Штаты и немедленно делает пожертвование американцу в группе пациентов, ожидающих длительного диализа, завершая цепочку.Это позволяет консервативным оценкам экономии затрат и позволяет избежать необходимости явного моделирования неопределенностей, связанных со сборкой более длинной американской цепи, инициированной иностранным донором мостов. # Мы рассматриваем популяцию отечественных (американских) пациентов с долгой ожидаемой продолжительностью диализа, которые имеют частную страховку на первые 33 месяца диализа и которые могут получить почку от иностранного донора, являющегося частью диализа. последняя пара пациент-донор в цепочке трансплантаций, проведенных за границей. Чтобы развить интуицию, мы начнем с рассмотрения в качестве примера (слишком) простой детерминированной модели. Пример : Предположим, что один домашний пациент приходит в бассейн каждый день. Пациент покидает бассейн, если она не подходит (т. Е. Не получила трансплантат) через 33 мес. Пациенты проходят диализ во время ожидания в бассейне, который оплачивается частным плательщиком из расчета D на пациента в день. Посторонний донор моста прибывает в пул каждые n дней, начиная с момента времени 0, где n> 1 — целое число.Любой донор совместим с каждым пациентом и, следовательно, может быть сопоставлен с любым пациентом. Общая стоимость каждого совпадения составляет S, понесенная частным плательщиком. В соответствии с политикой распределения LIFO прибывающий иностранный донор мостовидного протеза сопоставляется с совместимым пациентом с самым последним временем прибытия, присутствующим в пуле. Таким образом, в соответствии с политикой LIFO, каждый донор по прибытии сопоставляется с пациентом, который прибыл в то же время и, таким образом, имеет время ожидания 0. Следовательно, уменьшение n (то есть увеличение скорости прибытия иностранных доноров мостовидного протеза) снижает среднее время ожидания. время для домашних пациентов в соответствии с политикой LIFO за счет увеличения доли пациентов с нулевым временем ожидания.Следовательно, когда S достаточно мало по сравнению с D, уменьшение n снижает общие затраты, понесенные частным плательщиком в единицу времени в соответствии с политикой LIFO. Напротив, в соответствии с политикой распределения по принципу «первым пришел — первым ушел» (FIFO), иностранный донор моста сопоставляется с пациентом с самым ранним временем прибытия, присутствующим в пуле. Таким образом, в стабильном состоянии в соответствии с политикой FIFO каждый донор по прибытии сопоставляется с пациентом, который прибыл на 33 месяца раньше. Следовательно, уменьшение n (то есть увеличение скорости прибытия иностранных доноров мостов) не изменяет среднее время ожидания в соответствии с политикой FIFO, пока n> 1.Следовательно, уменьшение n увеличивает стоимость в соответствии с политикой FIFO, поскольку увеличивает затраты на операцию, но не вычитает никаких затрат на диализ. ∥ Этот простой пример показывает, что GKC имеет возможность самофинансироваться в масштабах, приближающихся к показателям количества прибывающих домашних пациентов, которые могут рассчитывать на диализ в течение всего времени, пока они находятся под частным страхованием. Это также показывает важность политики LIFO по сравнению с политикой FIFO; экономия на диализе достигается в рамках политики LIFO, но не политики FIFO.Это связано с тем, что до тех пор, пока количество доноров меньше, чем количество пациентов, всегда будут пациенты, которых частный плательщик поддерживает в течение полных первых 33 месяцев диализа, так что политика FIFO при трансплантации такой же количество пациентов, установленное политикой LIFO (и неся такие же дополнительные расходы на операции), не снижает затрат плательщика на диализ. Этот простой пример не учитывает существенный стохастический характер прибытий, отправлений, длин зарубежных цепочек и т. Д.Затем мы рассмотрим формальную модель, с помощью которой мы можем показать, что интуиция, полученная из примера, устойчива к этим особенностям. Формальная модель.Домашние пациенты прибывают в соответствии с процессом Пуассона со скоростью m. Каждый пациент остается в бассейне в течение ζ> 0 единиц времени, а затем уходит. Иностранные доноры мостов прибывают в соответствии с пуассоновским процессом со скоростью λm, где λ — параметр политики, который необходимо установить. Мы предполагаем, что донор моста b является последним донором в цепочке, включающей lb иностранных пациентов.Случайная величина lb выбирается независимо для каждого донора моста b из распределения F со средним значением μ. Мы предполагаем, что каждый донор моста совместим с каждым пациентом независимо с вероятностью r> 0. Планировщик применяет политику распределения LIFO. Когда прибывает иностранный донор мостовидного протеза, ему или ей подбирают совместимого пациента с указанием самого последнего времени прибытия. Если в бассейне нет пациента, донор немедленно уезжает. (Это упрощающее допущение можно понимать как то, что донор-мост продолжает цепочку в родной стране, возможно, завершив ее, сделав пожертвование кому-то из списка ожидания умершего донора в родной стране.) Пусть D обозначает внутренние затраты на диализ на пациента в единицу времени. Кроме того, пусть Sd и Sf обозначают затраты на пересадку почки в стране и за рубежом соответственно. Определите C (m, λ) как среднее значение на одного домашнего пациента в единицу времени общих затрат на здравоохранение, когда параметр политики равен λ. Обратите внимание, что C (m, λ) также учитывает все расходы иностранных пациентов. Определим C (λ) = limm → ∞C (m, λ). Следующий результат вычисляет производную средних затрат на здравоохранение по λ и показывает, что на большом рынке увеличение λ снижает общие затраты на здравоохранение.(Обратите внимание, что ζD — это стоимость диализа для пациента, которому не была сделана трансплантация.) Теорема 2.1. Согласно политике LIFO , для любого λ∈ (0,1), C ′ (λ) = Sd + μSf − ζD. Доказательство теоремы также приводит к аналогичному результату для конечных рынков. Этот результат, сформулированный в следующей теореме, показывает, что для любого конечного m увеличение λ на любое положительное ϵ <1 − λ, которое не является «слишком маленьким», уменьшает C (m, λ), если ζD> Sd + μSf. Теорема 2.2. Предположим, что ζD> Sd + μSf. Затем , для любого фиксированного м, увеличение λ на любое положительное значение ϵ <1 − λ уменьшает C (m, λ) , если ϵ> γ⋅ζDζD − Sd − μSf, , где γ≤2ζm + 1 + rr⋅log (ζmλ + 1) ζm. Эта теорема требует, чтобы ϵ не было слишком маленьким. Правая часть ограничения, которое гарантирует, что не слишком мало, — это параметр γ, умноженный на константу, не зависящую от m. ** Обратите внимание, что γ приближается к нулю со скоростью logmm по мере увеличения m.Следовательно, с ростом m нижняя граница становится существенно необязательной. Краткое изложение этих теорем выглядит следующим образом. Всякий раз, когда пациент собирается войти в систему в соответствии с политикой LIFO, он подбирается с вероятностью, близкой к λ. Таким образом, увеличение λ на снижает ее ожидаемые затраты на диализ примерно на ϵζD и увеличивает ожидаемые затраты на трансплантацию на (Sd + μSf), понесенные ее собственным трансплантатом и предыдущей цепочкой. Таким образом, C ′ (λ) = Sd + μSf − ζD. Для того, чтобы средние расходы на здравоохранение уменьшались с увеличением количества доноров мостов, обе вышеприведенные теоремы требуют ζD> Sd + μSf.Затем мы оценим это условие, используя оценочные значения его параметров (36). В Соединенных Штатах диализ стоит около 250 000 долларов на пациента в год для коммерческого плательщика, а трансплантация стоит около 100 000 долларов, за которыми следует стоимость иммуносупрессивных препаратов и последующего ухода, что составляет около 30 000 долларов в год. Мы учитываем 10 лет приема иммунодепрессантов и последующего лечения и, следовательно, устанавливаем Sd = 400 000 долларов США. Мы учитываем стоимость трансплантации для иностранного пациента, используя для нашего примера Филиппины, как стоимость операции в размере 12 000 долларов плюс 10 лет иммуносупрессивных препаратов и последующее лечение стоимостью около 6000 долларов в год.Следовательно, мы устанавливаем Sf = 72 000 долларов США. † † Для этих значений параметров условие ζD> Sd + μSf выполняется, если μ≤3,99. Следовательно, согласно приведенным выше оценкам, политика LIFO снижает общие расходы на здравоохранение, когда средняя длина иностранных цепочек не превышает 3,99. Мы отмечаем, что простой статический аргумент «изнутри», основанный на текущих расходах на диализ и операцию, недостаточен для установления этих результатов; такой аргумент игнорирует контрфактические издержки, которые зависят от динамики.Например, предположим, что планировщик переключается на политику FIFO. В этом случае увеличение λ на любое ϵ <1 − λ приведет к увеличению общих затрат! То есть до тех пор, пока количество доноров мостовидного протеза GKC ниже того, что необходимо для обеспечения трансплантации для всех домашних пациентов, в соответствии с политикой FIFO все домашние пациенты будут иметь время ожидания ζ, независимо от того, будут они трансплантированы или нет. Таким образом, увеличение λ не повлияет на средние затраты на диализ, оплачиваемые частным страховщиком, хотя это приведет к увеличению затрат на трансплантацию для иностранных пациентов.Следующая теорема фиксирует этот эффект. Теорема 2.3. Согласно политике FIFO , для любого λ∈ (0,1), C ′ (λ)> 0. Следовательно, анализ затрат и выгод в значительной степени зависит от динамики рынка. Анализ чувствительности политики LIFO: моделированиеВ этом разделе мы используем моделирование, чтобы дать некоторое представление о том, как общие затраты C (m, λ) меняются при LIFO и двух связанных политиках распределения в зависимости от λ, скорости, с которой прибывают зарубежные доноры мостов.LIFO можно несколько модифицировать без значительного сокращения затрат, но внимание к сэкономленным месяцам диализа остается важным до тех пор, пока скорость прибытия иностранных доноров не станет сопоставимой с частотой прибытия трудно сопоставимых отечественных пациентов. Для базовой настройки мы принимаем m = 2000 и принимаем те же оценки для параметров ζ, D, Sd и Sf, что и в предыдущем разделе. Также предполагаем, что r = 1. Качественные результаты нечувствительны к выбору r. В первом моделировании мы рассматриваем параметры базового случая и исследуем, как увеличение λ от нуля до m меняет общие затраты на здравоохранение в соответствии с политикой LIFO.На рис. 1 показан процент снижения общих затрат на здравоохранение [то есть C (m, 0) -C (m, λ) C (m, 0) × 100] как функцию от λ. Рис. 1.Мы отображаем процент снижения общих затрат на здравоохранение при изменении λ от 0 до 2000 с шагом 100 для трех различных политик распределения. LIFO, последний пришел, первый ушел; GEOLIFO, геометрический последний пришел, первый ушел; SIRO, выбор в случайном порядке. Вторая симуляция аналогична первой, но политика LIFO заменяется геометрической политикой «последний пришел — первым ушел» (GEOLIFO).В соответствии с этой политикой прибывающий иностранный донор сопоставляется с последним прибывшим совместимым пациентом с фиксированной вероятностью p0. С вероятностью 1 − p0 сопоставление не проводится, и донор сопоставляется со следующим последним прибывшим пациентом независимо с вероятностью p0 и так далее. Мы предполагаем, что p0 = 110, и строим график сокращения общих затрат на здравоохранение при изменении λ на рис. 1. Как и в базовой настройке, увеличение λ снижает общие затраты на здравоохранение для всех λ, рассматриваемых в моделировании. Однако обратите внимание, что две кривые почти друг над другом; GEOLIFO экономит практически столько же месяцев диализа, сколько LIFO. Третье моделирование такое же, как и первое, за исключением того, что политика выделения изменяется с LIFO на выбор в случайном порядке (SIRO). Эта политика сопоставляет донора моста с домашним пациентом, выбранным равномерно случайным образом из набора всех совместимых пациентов в пуле. Опять же, увеличение λ снижает общие затраты на здравоохранение, но теперь мы видим, что, если количество иностранных доноров не приблизится к количеству отечественных пациентов, экономия средств значительно снизится. Операционные вопросыХотя в этом документе основное внимание уделяется долгосрочной осуществимости, стоит сделать паузу, чтобы рассмотреть некоторые важные операционные вопросы.Например, в то время как GKE предполагает установление сотрудничества с зарубежными центрами трансплантации, GKC предполагает установление сотрудничества с зарубежными программами обмена почек. Во многих случаях это будет включать помощь в создании этих программ путем предоставления рекомендаций по передовому опыту, программному обеспечению и т. Д. (См. Ссылку 15), так что программы обмена почек могут быть созданы в существующих центрах трансплантации. Следует позаботиться о том, чтобы доноры в глобальной цепочке соответствовали законам обеих стран (например,g., что они являются здоровыми донорами, способными дать добровольное информированное согласие). Для установления статуса донора может потребоваться больше внимания, чем при внутреннем обмене почки в Соединенных Штатах. Может быть разумным провести начальные глобальные цепочки так, чтобы все операции проводились одновременно, поскольку цепочки обмена почек проводились в Соединенных Штатах до того, как был накоплен значительный успешный опыт с неодновременными цепочками. Мы ожидаем, что после установления надежных процедур глобальные цепочки также могут проводиться неодновременно. Среди расходов, которые должны будут быть покрыты программой обмена почки, будут затраты на обследование потенциальных доноров (многие из которых не станут фактическими донорами), как это в настоящее время имеет место в случае обмена почки в США. Если эти расходы не могут быть покрыты программой обмена почек за рубежом, они могут стать частью накладных расходов, которые должны покрываться за счет глобального обмена. Заключительные замечанияС начала двадцать первого века масштабный обмен почками превратился из в значительной степени академической идеи, первоначально реализованной в небольших масштабах (5, 37), до стандартного режима трансплантации в Соединенных Штатах (с более 1000 обменных трансплантатов в 2019 году) и в нескольких других странах.Это было важным событием, на его пути было много этапов, включая, что особенно важно, разработки и внедрение цепочек обмена почек. Однако эти достижения были победами в войне, которую мы проигрываем. На рубеже веков в американском списке ожидания умерших донорских органов находилось около 40 000 пациентов, а сегодня их почти 100 000. ‡‡ Ситуация похожа и в других странах богатого мира. За тот же период во всем мире наблюдался рост заболеваний почек как причины смерти (поскольку развивающиеся страны добились прогресса в борьбе с инфекционными заболеваниями), и в странах со средним уровнем дохода начали появляться высококачественные центры трансплантации. так же, как и в богатых странах, которые, тем не менее, сталкиваются с препятствиями, в том числе с серьезными финансовыми препятствиями, на пути увеличения количества трансплантатов, которые они могут доставить. §§ До развития обмена почек организация трансплантации развивалась в основном в пределах национальных границ богатых стран. В первую очередь он был сосредоточен на трансплантации от умершего донора, а нехватка органов означала, что концентрация усилий в пределах одной страны не оказала большого влияния на общее количество трансплантаций. (Имеются хорошо зарекомендовавшие себя попытки поделиться почками умерших доноров через национальные границы в ограниченных обстоятельствах.С ростом обмена почек в настоящее время ведутся некоторые предварительные исследования по координации трансграничной координации между странами с существующими программами обмена почек, в первую очередь концентрируясь на поиске обменов между труднопроходимыми парами, которым не удалось найти себе равных в обмене почек внутри страны. GKE открывает эту возможность для гораздо большей части мира, включая страны, в которых несопоставленные пары пациент-донор могли иметь финансовые, а не иммунологические барьеры, и поэтому их может быть легче сопоставить с парами, которые трудно подобрать.Кроме того, поскольку цепочки обмена почек усилили обмен почек, где бы они ни были реализованы, глобальные цепочки обмена предлагают способ донести эти преимущества до гораздо большей группы пациентов и доноров. ¶¶ В то время как Medicare стремится застраховать всех американцев от болезней почек, та же экономия затрат, описанная здесь, может быть использована для финансирования лечения незастрахованных иностранных пациентов, включая тех, которые являются иммигрантами без документов, которые, возможно, не въехали в страну легально. (но, тем не менее, могут быть постоянными жителями). ## Обратите внимание, что если международный обмен работает безупречно, т. Е. Когда все вовлеченные пациенты и доноры прошли успешные операции, получили отличное последующее наблюдение и восстановили активное, длительное хорошее здоровье, тогда он легко будет рассматривать обмен как еще один пример успеха стандартного обмена почек, при котором все пациенты из одной страны. Однако, если пара из развивающейся страны вернется домой с плохим состоянием здоровья, это будет очень похоже на плохо организованные операции на черном рынке, которые справедливо осуждаются.Таким образом, чтобы обмен почками работал между развитыми и развивающимися странами, донорам и пациентам из развивающихся стран необходимо будет оказывать исключительную помощь, особенно потому, что пациенты из бедных стран — например, их соотечественники, которые никогда не страдали заболеваниями почек, — могут ожидать имеют несколько худшие показатели здоровья, чем сопоставимые в других отношениях люди в богатых странах, независимо от того, какие усилия были предприняты для оказания им наилучшего возможного послеоперационного ухода. Международный обмен может также потребовать большей бдительности по сравнению с внутренним обменом, чтобы гарантировать, что доноры не будут принуждены или иным образом использованы.Следовательно, первым элементом успешного дизайна GKC является выбор надежных международных партнеров, способных обеспечить превосходный уход за пациентами и донорами как в проспективном, так и в послеоперационном периоде. Остальные три элемента дизайна, предложенные и исследованные в этой статье, включают начало цепочки в другой стране и продолжение ее донором моста в Соединенных Штатах; использование политики очереди LIFO для пула пациентов, собранных, например, коалицией самострахованных компаний, ответственных за оплату их лечения; и за счет этих сбережений финансируются дополнительные расходы, не обеспеченные в противном случае (по сравнению с полностью внутренней цепочкой) в обеих странах.Как мы показали, такая программа могла бы работать в значительных масштабах, сопоставимых с количеством домашних пациентов, ежегодно начинающих длительный диализ. Таким образом, GKC представляют собой масштабируемый подход к трансграничному обмену почек и к увеличению доступности трансплантации во всем мире. Они могут стать, по крайней мере, первым шагом на пути к глобальному решению глобальной проблемы почечной недостаточности. Доступность данныхНет данных, лежащих в основе этой работы. БлагодарностиЭта работа частично поддержана грантом NSF 1061932 Национальному бюро экономических исследований. Мы благодарим Филипа Хелда, Вахидеха Маншади, Фрэнка Маккормика, Зигфредо Р. Палойо, Ллойда Ратнера и наших рецензентов за полезные комментарии. Сноски
Покрытие трансплантата почкиMedicare, часть A (больничное страхование)покрывает эти услуги по трансплантации:
покрывает эти услуги по трансплантации:
Препараты для трансплантации
Medicare будет продолжать оплачивать лекарства для трансплантации без ограничения по времени, если выполняется одно из следующих условий:
Ваши расходы по программе Original Medicare
Важно: Существует ограничение на сумму, которую ваш врач может взимать с вас, даже если ваш врач не принимает назначение. Если вы в автомобиле План Medicare Advantage (Часть C), то, что вы платите, может отличаться.Узнайте больше о планах Medicare Advantage, если у вас есть ESRD. note:Чтобы узнать, сколько будет стоить ваш тест, предмет или услуга, поговорите со своим врачом или поставщиком медицинских услуг. Конкретная сумма вашей задолженности может зависеть от нескольких факторов, например:
note:Ваш врач или другой поставщик медицинских услуг может порекомендовать вам получать услуги чаще, чем покрывает Medicare.Или они могут порекомендовать услуги, которые не покрываются программой Medicare. В этом случае вам, возможно, придется оплатить некоторые или все расходы. Задавайте вопросы, чтобы понять, почему ваш врач рекомендует определенные услуги и будет ли за них платить Medicare. Что нужно знать Medicare покроет вашу трансплантацию почки только в том случае, если она будет сделана в больнице, имеющей сертификат Medicare для проведения трансплантации почки. |
 Медицинская страховка обычно покрывает трансплантацию почки.
Медицинская страховка обычно покрывает трансплантацию почки.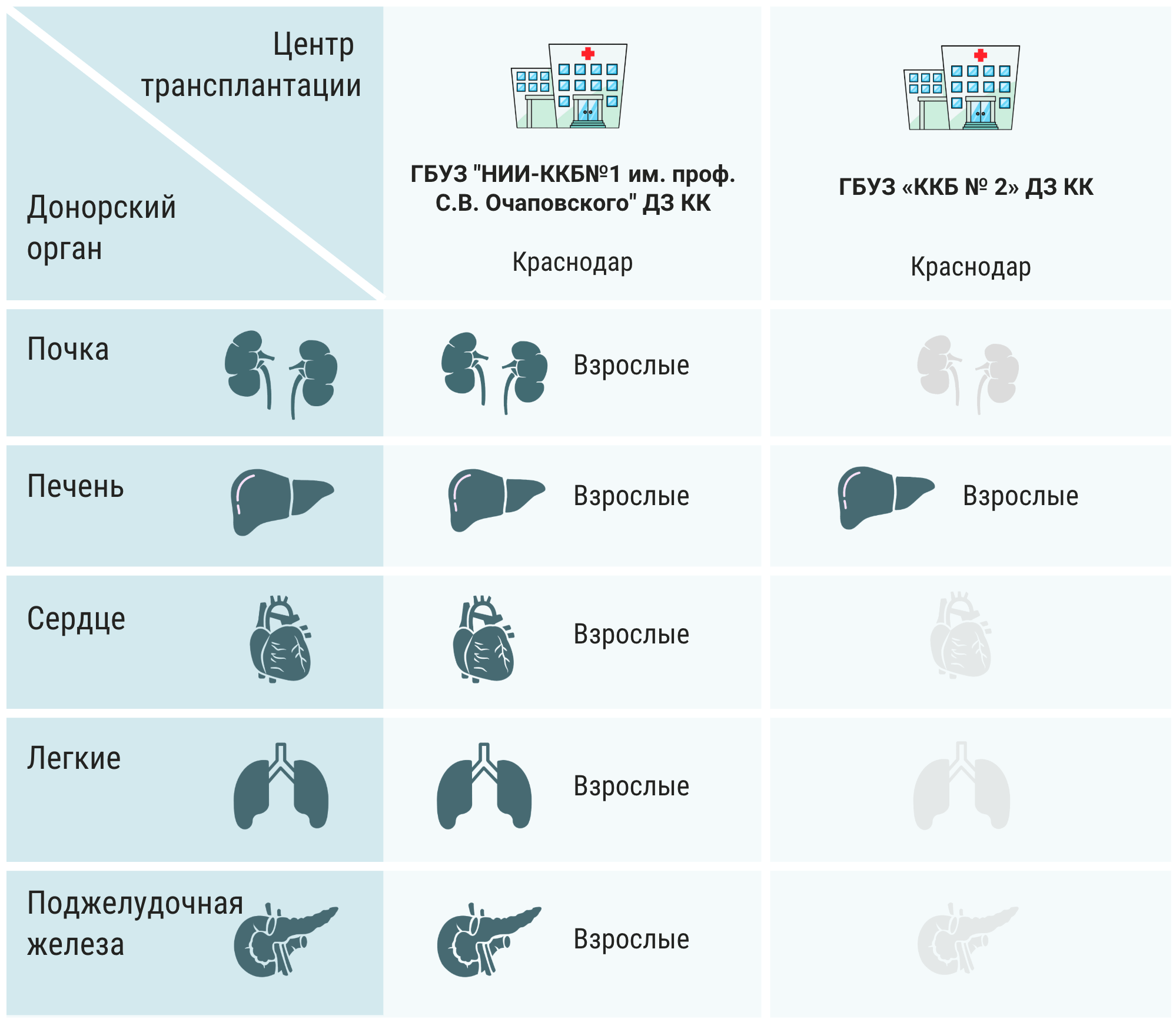

 org/treatment-options/dialysis-transplant -comparison /
org/treatment-options/dialysis-transplant -comparison / Несмотря на всю шумиху вокруг достижений в клинической практике и технологиях, американская медицина придерживается нейтральной позиции. Несмотря на то, что двигатель громко набирает обороты, прогресса не наблюдается.
Несмотря на всю шумиху вокруг достижений в клинической практике и технологиях, американская медицина придерживается нейтральной позиции. Несмотря на то, что двигатель громко набирает обороты, прогресса не наблюдается.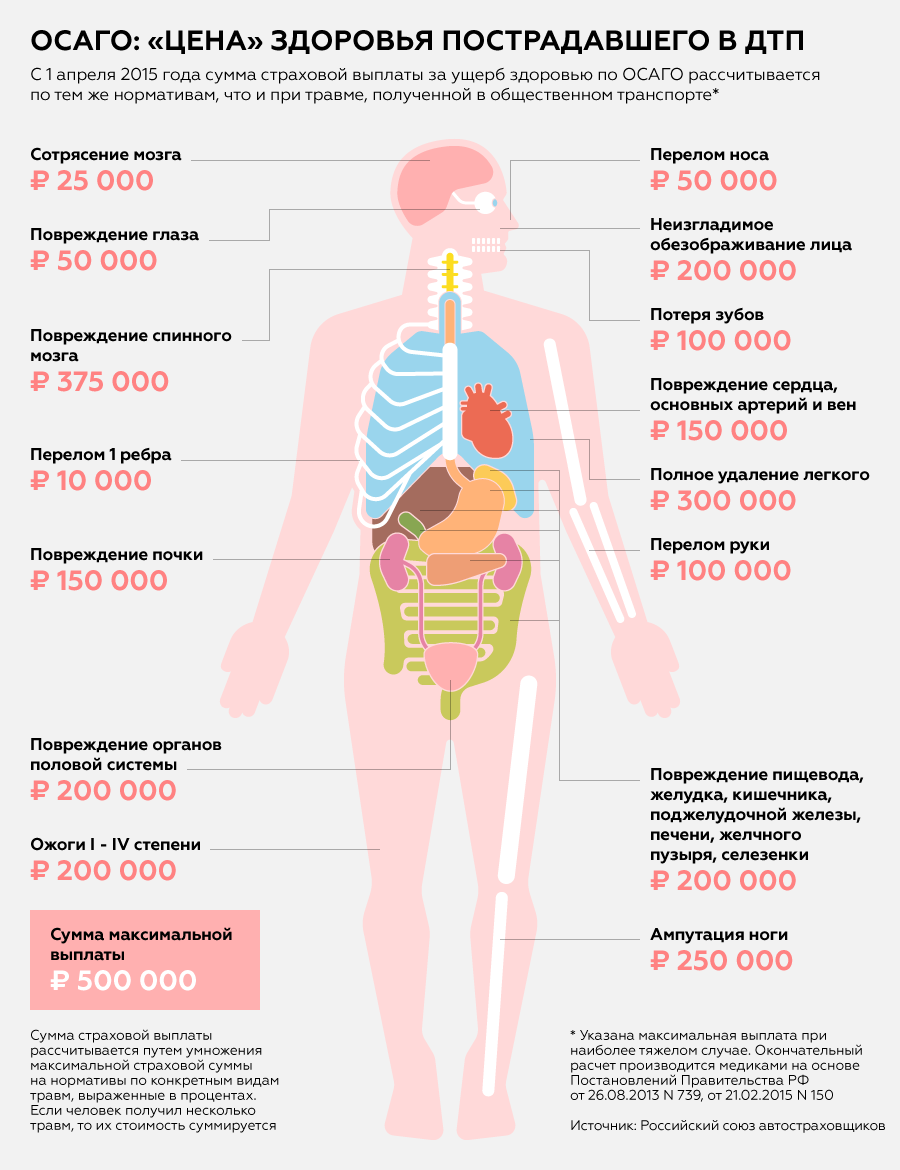 человек.»
человек.» Найти живых доноров лучше всего по нескольким причинам. Во-первых, трансплантация почек с участием «живых» доноров более успешна, чем при извлечении органов у умершего. Во-вторых, миллионы американцев могут внести свой вклад.
Найти живых доноров лучше всего по нескольким причинам. Во-первых, трансплантация почек с участием «живых» доноров более успешна, чем при извлечении органов у умершего. Во-вторых, миллионы американцев могут внести свой вклад. Однако это беспокойство не основано на фактах. Согласно данным UCSF, заболевание почек непропорционально поражает национальных меньшинств и пациентов с низкими доходами. Следовательно, государственная программа закупки почек принесет несоразмерную пользу бедным, а не богатым.
Однако это беспокойство не основано на фактах. Согласно данным UCSF, заболевание почек непропорционально поражает национальных меньшинств и пациентов с низкими доходами. Следовательно, государственная программа закупки почек принесет несоразмерную пользу бедным, а не богатым.
 Это необходимо для исключения потенциально опасного загрязнения.И хотя передаваемые инфекции очень редки, они подозреваются примерно в 1% случаев трансплантации, хотя на самом деле обнаруживаются в гораздо меньшем количестве, как показывают данные Центров по контролю и профилактике заболеваний (CDC). «Доноры проходят тщательный скрининг, и инфекции можно хорошо лечить», — говорит доктор Классен. «Существует компромисс между риском и вознаграждением, и это относительно небольшой риск», — добавляет он.
Это необходимо для исключения потенциально опасного загрязнения.И хотя передаваемые инфекции очень редки, они подозреваются примерно в 1% случаев трансплантации, хотя на самом деле обнаруживаются в гораздо меньшем количестве, как показывают данные Центров по контролю и профилактике заболеваний (CDC). «Доноры проходят тщательный скрининг, и инфекции можно хорошо лечить», — говорит доктор Классен. «Существует компромисс между риском и вознаграждением, и это относительно небольшой риск», — добавляет он. Возьмите гепатит C. «К счастью, гепатит C стал излечимым заболеванием за последние пять лет, поэтому мы все еще можем использовать орган человека с гепатитом C, а затем лечить реципиента лекарствами от гепатита C.»
Возьмите гепатит C. «К счастью, гепатит C стал излечимым заболеванием за последние пять лет, поэтому мы все еще можем использовать орган человека с гепатитом C, а затем лечить реципиента лекарствами от гепатита C.»
 Люди, которые едут в другие страны для трансплантации органов, могут не осознавать, что их донор может быть невольным участником — заключенным, беженцем или бедным человеком, — отмечается в прошлой международной декларации о торговле органами.«Это незаконно в большинстве стран. В некоторых частях мира это можно сделать, но это рискованно, опасно и плохо регулируется », — говорит Классен.
Люди, которые едут в другие страны для трансплантации органов, могут не осознавать, что их донор может быть невольным участником — заключенным, беженцем или бедным человеком, — отмечается в прошлой международной декларации о торговле органами.«Это незаконно в большинстве стран. В некоторых частях мира это можно сделать, но это рискованно, опасно и плохо регулируется », — говорит Классен.
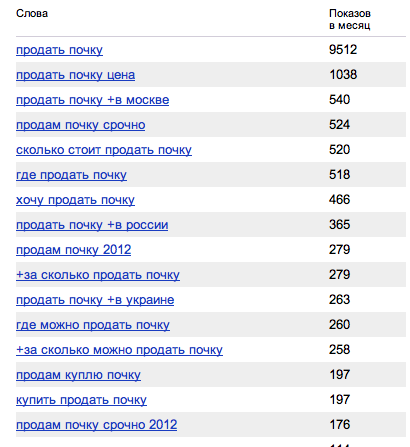

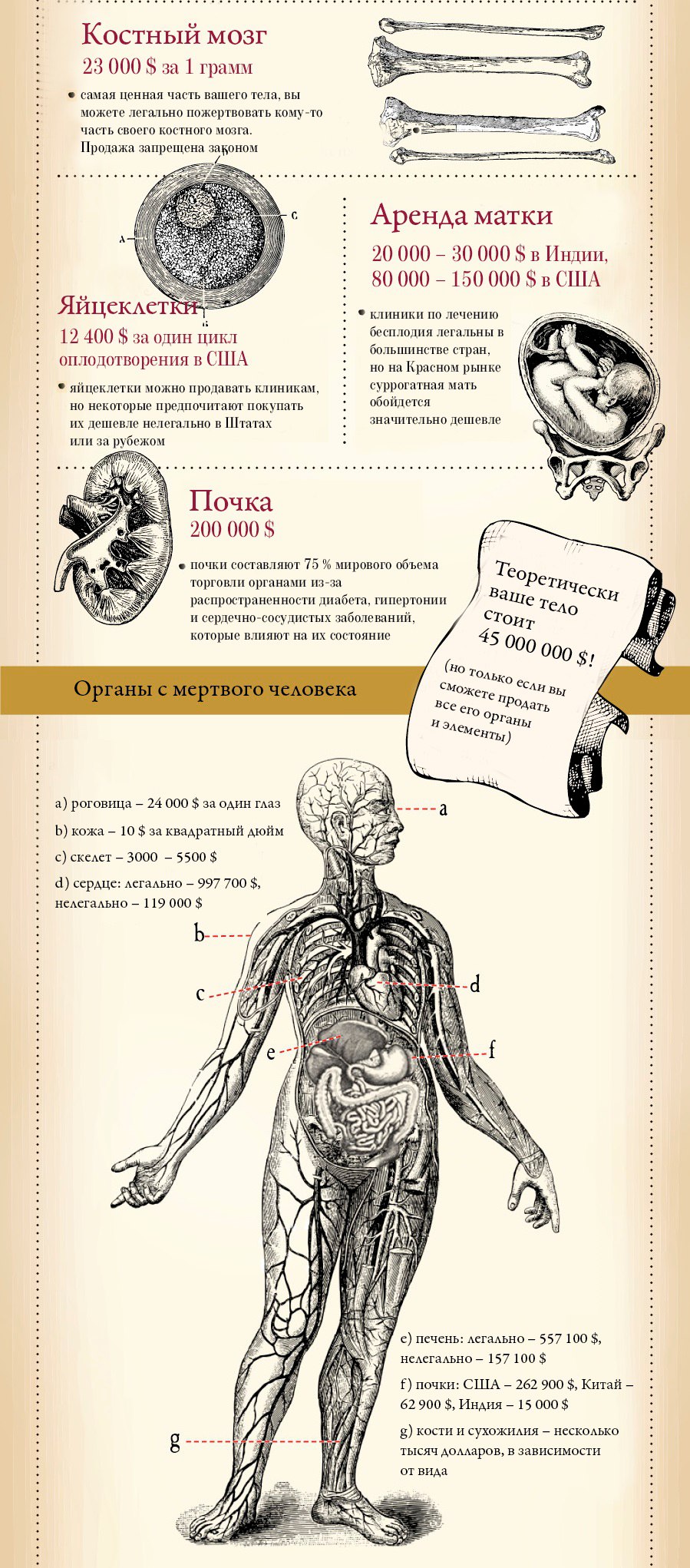
 «В некоторых частях страны, таких как Калифорния и густонаселенные городские районы, время ожидания больше», — объясняет Классен.
«В некоторых частях страны, таких как Калифорния и густонаселенные городские районы, время ожидания больше», — объясняет Классен. Раньше почки брали только у живых близких родственников или у недавно умерших людей. Трансплантаты от живых доноров имеют больше шансов на успех, чем трансплантаты от умерших доноров. Кроме того, в Соединенных Штатах некоторые люди ждут более 5 лет, чтобы получить трупную почку. сноска 1 По этой причине все больше людей принимают решение стать донорами почки.
Раньше почки брали только у живых близких родственников или у недавно умерших людей. Трансплантаты от живых доноров имеют больше шансов на успех, чем трансплантаты от умерших доноров. Кроме того, в Соединенных Штатах некоторые люди ждут более 5 лет, чтобы получить трупную почку. сноска 1 По этой причине все больше людей принимают решение стать донорами почки.