Москва — интересные факты о городе, статистические данные
Москва – столица России, политический, экономический и культурный центр. Самый населенный город России и Европы. Для многих россиян и иностранцев российская столица – это город больших возможностей.
Европейская столица
По инфраструктуре и жизненному укладу Москва во многом похожа на европейскую столицу, а ее жители – на типичных обитателей мегаполисов от Лондона до Нью-Йорка. Это делает ее понятной и легкой для адаптации иностранцев.
Город событий
Москва – это город, в котором постоянно что-то происходит – выставки, фестивали, перформансы, экскурсии, концерты, квесты, марафоны… В российской столице можно интересно провести время, не потратив при этом огромную сумму денег: увидеть город с высоты птичьего полета, прокатиться на теплоходе по Москве-реке, спуститься на глубину 65 метров в бункер времен холодной войны, сходить на уроки рисования или игры на гитары, пройтись по московским барам или поучаствовать в винной дегустации, погонять на роликах в парке или побывать в зеркальном лабиринте…
Один из лучших городов мира для студентов
Москва дважды – в 2014 и 2015 году – входила в рейтинг лучших городов для студентов по версии компании Quacquarelli Symonds (QS). Эксперты, в частности, оценивали популярность мегаполиса среди студентов, престиж его университетов, доступность обучения.
Эксперты, в частности, оценивали популярность мегаполиса среди студентов, престиж его университетов, доступность обучения.
Спортивный город
В Москве находится свыше 9,5 тысяч спортивных сооружений, в том числе более 4 тысяч спортзалов. В российской столице постоянно проходят спортивные мероприятия – марафоны, соревнования общенационального и международного масштаба. Один из главных праздников «Спортивный город», который собирает более 70 тысяч студентов столичных вузов. Во время него в центре Москвы сооружается грандиозная площадка, на которой размещаются более 50 спортивных секций. Любой желающий может попробовать свои силы в самых разных видах спорта ‑ от городского маунтинбайка до сумо.
Город парков
Большое количество парков, скверов, садов в Москве порой удивляет иностранцев. Их в российской столице более 120-ти, чаще всего это просторные площадки с зелеными насаждениями, оборудованные всем необходимым для комфортного отдыха – скамейками, Wi-Fi, кафе, дорожками и площадками для занятия спортом и многим другим.
Самое красивое в мире метро
Московская подземка – не только способ передвижения горожан и гостей города, но и одна из его достопримечательностей, культурный объект, где даже устраивают туристические экскурсии. Станции отделаны мрамором, украшены мозаикой и скульптурами, самые красивые станции – «Маяковская», «Киевская», «Комсомольская», «Новослободская». Особой популярностью среди студентов пользуется станция «Площадь Революции» со скульптурой пограничника и собаки. Согласно поверью, если перед экзаменом потереть псу нос, то отличная оценка обеспечена.
Самая большая в Европе библиотека
Российская государственная библиотека, где собрано более 45,5 миллиона изданий и документов на 367 языках мира, находится в самом центре Москвы, на улице Воздвиженка. Работает интернет-зал, электронный поиск документов и буфет. Записаться в библиотеку может любой желающий, достаточно предъявить паспорт с визой (с переводом на русский язык).
Записаться в библиотеку может любой желающий, достаточно предъявить паспорт с визой (с переводом на русский язык).
Многонациональный город
По данным социологов, лишь 2% из более чем 12-миллионного населения Москвы, являются коренными жителями. Только за последние 20 лет в столицу из других регионов России переехали 3 миллиона человек, а число постоянно проживающих иностранцев (не считая выходцев из СНГ) оценивается в 300 тысяч человек. В Москве комфортно себя чувствуют представители самых разных стран, приверженцы различных религий – в городе есть православные храмы, синагоги, мечети, католические церкви, буддистские центры и др. Неслучайно британская газета The Independent назвала российский город-космополит самым дружелюбным для иностранцев.
Рестораны и кафе
В Москве вы найдете самые разные рестораны и кафе. Здесь французская булочная соседствует с тирольским кафе и ресторанчиком с 30-ю сортами бельгийского пива, китайская закусочная борется за посетителей с вьетнамской лапшичной. И, конечно, в городе огромное количество заведений русской кухни. Для студентов найдутся вполне доступные кафе, магазины, сервисы по заказу еды с доставкой.
И, конечно, в городе огромное количество заведений русской кухни. Для студентов найдутся вполне доступные кафе, магазины, сервисы по заказу еды с доставкой.
Город, который никогда не спит
Москва известна своей насыщенной ночной жизнью. В столице несметное количество клубов, дискотек и развлекательных центров. Кроме того, ночью можно отправиться на экскурсию по городу (пешую или автобусную) или принять участие в театрализованных представлениях столичных музеев. Ежегодно в городе проходит акция «Ночь музеев», во время которой бесплатно свои двери для посетителей открывают ведущие арт-площадки, проходят концерты, перформансы, театрализованные представления и мастер-классы.
Интересные факты о воде — Статья Аквамарина
16 февраля 2021
Вода считается основополагающим веществом для существования жизни на Земле. Все живые организмы на определенную долю состоят из нее и должны регулярно возобновлять ее запас. Так, для человека показатель в среднем составляет 1000 литров воды в год.
Так, для человека показатель в среднем составляет 1000 литров воды в год.
Кажется, что эта цифра достаточно небольшая, и мы будем иметь необходимое количество жизненно важной жидкости всегда. Ведь планета на 70% покрыта водой, а если ее равномерно распределить по всей площади Земли, толщина слоя достигнет 3,7 км. Но учтите, что 97% от всего этого объема – соленая вода. При этом для питья пригодно даже не 3%, что остались, а всего 1%. И состояние этого 1% постоянно ухудшается из-за техногенных, антропогенных факторов. Вода загрязняется, становится дефицитом для целых регионов, и даже из-под крана мы не всегда получаем пригодную, безопасную жидкость. Поэтому лучше пить специально подготовленную бутилированную воду.
Чтобы сохранить запас не только для себя, но и для следующих поколений, нам стоит задуматься о рациональном использовании воды. Чтобы понять, как это сделать, ознакомимся с интересными фактами об h3O.
1. Чашка кофе – это 200 литров воды
Чашка кофе – это 200 литров воды
Не стоит это воспринимать буквально. Имеется ввиду, что пока для вашей одной чашки американо растут зерна, только для них дерево должно потребить 200 литров водного ресурса. Еще один пример – пшеница. Всего для выращивания злаков на 2 кусочка хлеба нужно потратить 100 литров воды. А на выращивание 1 кг риса уходит целых 4000 литров жидкости.
2. У воды есть свой международный день
Генеральная Ассамблея ООН решила своеобразно напомнить человечеству о важности сохранения водных ресурсов. По этому поводу ввели международный праздник. Отмечают его ежегодно 22 марта.
3. Чище, чем у финнов, не бывает
Финляндия считается страной с самой чистой водой в мире. Официальное заключение сделано международной организацией ЮНЕСКО. Но даже там люди предпочитают потреблять подготовленную воду. Для исследования брали воду из 122 государств.
4. Кипяток замерзает быстрее
По логике охлажденная вода должна превращаться в лед быстрее теплой, так как ей не нужно остывать. Но на деле все происходит наоборот, и даже ученые пока точно не знают причины этого явления. Если вы оставите на морозе две чашки – с холодной водой и с кипятком, то горячая жидкость замерзнет быстрее.
5. У миллиарда людей нет доступа к чистой питьевой воде
Каждый 7-й житель планеты не может пить чистую, безопасную воду по причине отсутствия к ней доступа. А 400 млн землян вообще живут в условиях без регулярного доступа к питьевой воде. Проблема настолько глобальная, что за доступ к водным ресурсам даже были войны. Только за последние полвека произошел 21 вооруженный конфликт на этой почве. А в целом за это же время насчитывается более 500 случаев, когда люди не поделили ресурс.
6. Очищенная вода не замерзает при 0°C
Если в воде абсолютно нет примесей, она может сохраняться в жидком состоянии до температуры -42°C. Это происходит из-за того, что лед формируются возле частичек в воде. При этом кроме привычных нам трех агрегатных состояний она может приобретать и другие формы. Только в замерзшем состоянии насчитывается 14 агрегатных состояний вещества.
Это происходит из-за того, что лед формируются возле частичек в воде. При этом кроме привычных нам трех агрегатных состояний она может приобретать и другие формы. Только в замерзшем состоянии насчитывается 14 агрегатных состояний вещества.
7. Вода помогает похудеть
Если отказаться от напитков, соков и пить только воду, калорийность вашего рациона снижается, что позволяет сбросить лишний вес. После употребления чистой воды не такой сильный аппетит, как после сладких напитков, чая или кофе. В результате человек начинает питаться правильнее, соблюдает диету.
8. Значительная часть питьевой воды недоступна для человека
Весомая доля питьевой воды застыла в ледниках. Поэтому пока получить ее для употребления мы не можем. Всего ледники содержат 2% водного ресурса планеты.
9. Вода – распространитель болезней
Недостаточно очищенная вода становится причиной передачи 85% заболеваний. Чтобы не попасть под эту печальную статистику, стоит пить качественно подготовленную воду. А если при этом употреблять по 6 стаканов чистой воды на протяжении дня, это уменьшает риск и других заболеваний, например, тех, что касаются сердечно-сосудистой системы.
Чтобы не попасть под эту печальную статистику, стоит пить качественно подготовленную воду. А если при этом употреблять по 6 стаканов чистой воды на протяжении дня, это уменьшает риск и других заболеваний, например, тех, что касаются сердечно-сосудистой системы.
10. Только часть бутилированной воды действительно чистая и полезная
По статистике четверть продавцов предлагают под видом подготовленной бутилированной воды ту же самую жидкость, что течет у вас в водопроводе. Поэтому даже при покупке очищенного продукта стоит доверять только сертифицированным, проверенным поставщикам. В компании «Аквамарин» вы можете заказать качественную воду прямо из источника. В ней сохранены все полезные вещества, не содержится вредных примесей.
Проанализировав такие факты о воде, можно сделать вывод, что у нас ее не так уж и много. И нерациональное отношение к ресурсу может очень быстро стать причиной глобальной катастрофы.
Помните также, что неправильно подготовленная жидкость может навредить организму. Поэтому используйте для питья и употребления в пищу только качественный продукт. Если у вас нет возможности получить его непосредственно со скважины, лучше выбрать воду в бутылях, чем рисковать и пить ее из-под крана. А если вы считаете, что очистка жидкости из водопровода – это лучший выход, учтите, так вода не просто фильтруется от вредных примесей, но и теряет минералы, поэтому лишается полезных свойств.
15 интересных фактов, касающихся воды
Факт первый: самая чистая вода в Финляндии
По данным ЮНЕСКО, самая чистая вода находится в Финляндии. Всего в исследовании свежей природной воды принимало участие 122 страны. При этом 1 млрд людей по всему миру вообще не имеет доступа к безопасной воде.
Факт второй: лед быстрее получить из горячей воды
Какая вода быстрее превратится в лед: горячая или холодная? Если рассуждать логически, то, конечно, холодная. Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода.
Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода.
Точного ответа на вопрос, почему все-таки горячая вода замерзает быстрее холодной, до сих пор не существует. Возможно, дело в разнице в переохлаждении, испарении, образовании льда, конвекции, либо причина в воздействии разжиженных газов на горячую и холодную воду.
Факт третий: сверхохлаждение воды
Все хорошо помнят из школьного курса физики, что вода замерзает при 0 градусов, а при 100 градусах закипает. Однако существует так называемое сверхохлаждение воды. Таким свойством обладает очень чистая вода – без примесей. Даже при охлаждении ниже точки замерзания такая вода остается жидкой. Но и в том, и в другом случае существуют температуры, при которых вода станет льдом или закипит.
Факт четвертый: у воды более 3 состояний
Еще со школы все знают, что у воды есть 3 агрегатных состояния: жидкое, твердое и газообразное. Однако ученые выделяют 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде.
Однако ученые выделяют 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде.
Факт пятый: вода как стекло
Что будет, если взять замерзшую чистую воду и продолжить охлаждение? С водой произойдут чудесные превращения. При минус 120 градусах по Цельсию вода становится сверхвязкой или тягучей, а при температуре ниже минус 135 градусов она превращается в «стеклянную» воду. «Стеклянная» вода – это твердое вещество, в котором отсутствует кристаллическая структура, как в стекле.
Факт шестой: основа жизни – это вода
Вода – основа жизни. Все живые животные и растительные существа состоят из воды: животные – на 75%, рыбы – на 75%, медузы – на 99%, картофель — на 76%, яблоки — на 85%, помидоры — на 90%, огурцы — на 95%, арбузы — на 96%. Даже человек состоит из воды. 86% воды содержится в теле у новорожденного и до 50% у пожилых людей.
Факт седьмой: вода – переносчик болезней
Вода не только дарит жизнь, но может и отнимать ее. 85% всех заболеваний в мире передается с помощью воды. Ежегодно 25 млн. человек умирает от этих заболеваний.
85% всех заболеваний в мире передается с помощью воды. Ежегодно 25 млн. человек умирает от этих заболеваний.
Факт восьмой: человек без воды умирает
Если человек теряет 2% воды от массы своего тела, то у него возникает сильная жажда. Если проценты потерянной воды увеличатся до 10, то у человека начнутся галлюцинации. При потере в 12% человек не сможет восстановиться без помощи врача. При потере в 20% человек умирает.
Факт девятый: больше всего пресной воды – в ледниках
Где больше всего воды? Ответ кажется очевидным: в Мировом океане. Однако на самом деле, в мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане. При этом почти вся имеющаяся на планете масса воды не пригодна для питья. Мы можем пить только 3% воды – именно столько у нас запасов пресной воды. Но даже большая часть этих 3% недоступна, так как содержится в ледниках.
Факт десятый: вода как диета
С помощью воды можно бороться с лишним весом. Употребляя из напитков только воду, можно резко снизить общую калорийность рациона. Во-первых, потому, что человек прекращает пить калорийные сладкие газировки и соки, во-вторых, потому, что после воды меньше тянет взять сладостей, как в случае с чаем или кофе.
Употребляя из напитков только воду, можно резко снизить общую калорийность рациона. Во-первых, потому, что человек прекращает пить калорийные сладкие газировки и соки, во-вторых, потому, что после воды меньше тянет взять сладостей, как в случае с чаем или кофе.
Факт одиннадцатый: вода для здорового сердца
Вода помогает снизить вероятность сердечного приступа. Во время исследований ученые выяснили, что те люди, которые пьют около шести стаканов воды в день, меньше подвержены риску сердечного удара в отличие от тех, кто выпивает всего два стакана.
Факт двенадцатый: 35 тонн воды за жизнь
Без воды человек может прожить очень не долго. Потребность в воде стоит на втором месте после кислорода. Без еды человек может прожить около шести недель, а без воды – пять-семь суток. За всю свою жизнь человек выпивает примерно 35 т воды.
Факт тринадцатый: самая дорогая вода
Вода может быть бесплатной, а может быть и очень дорогой. Самая дорогая в мире вода продается в Лос-Анджелесе. Производители упаковывают драгоценную жидкость со сбалансированным вкусом и значением ph в бутылки со стразами «Swarovski». Стоит такая вода 90 $ за 1 л.
Самая дорогая в мире вода продается в Лос-Анджелесе. Производители упаковывают драгоценную жидкость со сбалансированным вкусом и значением ph в бутылки со стразами «Swarovski». Стоит такая вода 90 $ за 1 л.
Факт четырнадцатый: есть вода, которая горит
Существует и опасная вода. Так, например, в Азербайджане есть вода, в которой много метана, поэтому она может загореться, если поднести к ней спичку. А в Сицилии в одном из озер есть подводные источники кислоты, которые отравляют всю воду в этом водоеме.
Факт пятнадцатый: белок в воде
Морская вода – весьма питательная субстанция. В 1 куб. см такой воды содержится 1.5 г белка и других веществ. Ученые считают, что один только Атлантический океан по своей питательности оценивается в 20 тыс. урожаев, которые собирают за год по всей суше.
Интересные факты
Факты упрямая вещь! Но от этой подборки фактов по теме пожарная безопасность не станет
скучно детям. Почему!? Не согласны!? Полистайте их, и мы думаем, что вы с нами согласитесь. А
так как дети любознательный народ и задают много «почему?» и «от чего?!».. А у взрослых не
всегда есть логически верное объяснение на подобные вопросы, то эта подборка материала
может стать большим подспорьем.
Почему!? Не согласны!? Полистайте их, и мы думаем, что вы с нами согласитесь. А
так как дети любознательный народ и задают много «почему?» и «от чего?!».. А у взрослых не
всегда есть логически верное объяснение на подобные вопросы, то эта подборка материала
может стать большим подспорьем.
1. Почему нельзя бежать, если загорелась одежда?
Нельзя бежать — пламя разгорится еще сильнее! Постарайтесь быстро сбросить горящую одежду, хорошо, если рядом есть лужа или сугроб — ныряйте туда, если их нет, падайте на землю и катайтесь, пока не собьёте пламя. Ещё одна возможность — накинуть на себя любую плотную ткань (пальто или одеяло и пр.), оставив при этом голову открытой.
2. Почему горящее масло на сковороде нельзя заливать водой?
Нельзя заливать горящее масло водой, т.к. произойдет бурное вскипание, разбрызгивание горящего масла, ожоги рук, лица и множество очагов горения.
3. Почему нельзя оставлять без присмотра включенные электрические приборы?
Электроприборы, включенные в сеть, особенно такие, как электроутюги, электроплитки, обогреватели, нельзя оставлять без присмотра, т. к. возможен пожар.
к. возможен пожар.
4. Почему нельзя пользоваться спичками и эл. выключателями при запахе газа?
Малейшая искра или источник открытого огня (спичка, зажигалка…) могут привести к взрыву и пожару.
5. Почему нельзя оставлять готовящуюся еду на плите без присмотра?
Масла и жиры могут загореться вследствие выкипания или нагревания.
6. Почему нельзя хранить аэрозольные баллончики на солнце?
В аэрозольных баллончиках газ находится под давлением и нагреваясь на солнце или около открытого огня (плиты) расширяется, что приводит к взрыву и пожару.
7. Почему нельзя бросать горящие самолетики с балкона?
Они могут залететь в открытые окна и балконы и вызвать пожар.
8. Почему нельзя прятаться при пожаре под кроватью или в шкафу?
Вас не смогут найти пожарные и вы задохнетесь от дыма.
9. Почему нельзя пользоваться лифтом при пожаре?
При пожаре лифт будет отключен (из-за обесточивания дома). Поэтому ты можешь оказаться в ловушке и задохнуться.
Поэтому ты можешь оказаться в ловушке и задохнуться.
10. Почему нельзя открывать окна при пожаре?
Возникнет приток воздуха (сквозняк)и пожар станет больше.
11. Большинство людей, пострадавших при пожаре умирают не от ожогов, а от удушья или отравления угарными газами. Чем сильнее концентрация угарного газа, тем быстрее это приводит к бессознательному состоянию человека, его отравлению продуктами горения и смерти.
12. Чем опасен трамвай и троллейбус при пожаре?
Электрическим током, поэтому не прикасайся к металлическим частям в троллейбусе, трамвае — при пожаре они могут оказаться электрическим напряжением.
13. Чем опасен автобус при пожаре?
Взрывом бака с бензином, поэтому, покинув автобус, надо отойти на безопасное расстояние – 25-30 м.
14. Осколки стекла пожароопасны. В солнечную погоду эти осколки фокусируют солнечные лучи как зажигательные линзы.
15. Почему не хранят макулатуру и старые вещи на балконе?
Почему не хранят макулатуру и старые вещи на балконе?
Если брошенная сверху сигарета залетит на балкон и попадет на пожароопасные предметы, то произойдет возгорание и пожар.
16. Чем опасна паника при пожаре?
Не правильными действиями, т.к. спокойный человек действует быстро и взвешенно.
17. Почему надо двигаться ползком при задымлении?
Дым легче воздуха, поэтому около пола его концентрация ниже.
18. Зачем кладут металлический лист перед дверцей печи?
При открытой дверце печи могут вылетать искры и угольки, которые при попадании на пол или тряпку могут вызвать их возгорание.
19. Почему газовые баллоны не хранят в доме?
Газовые баллоны – источник потенциальной опасности взрыва и пожара.
20. Почему не накрывают эл. лампы бумагой или тканью?
Может произойти возгорание, т.к. уже через 30-40 минут после включения она нагревается до температуры 110-250 0С.
21. Почему нельзя включать в одну розетку много электрических приборов одновременно?
Электронагревательные приборы имеют большую потребляемую мощность, поэтому нельзя одновременно подключать несколько таких устройств к одной розетке – это может вызвать чрезмерный нагрев проводов, разрушение их изоляции, оплавление и возгорание розеток.
22. Чем опасен пожар?
Опасные факторы пожара — пламя и искры; тепловой поток; повышенная температура окружающей среды; повышенная концентрация токсичных продуктов горения и термического разложения; пониженная концентрация кислорода; снижение видимости в дыму.
23. Почему петарды не носят в карманах?
Они могут самопроизвольно взорваться и тем самым нанести урон физическому здоровью (раны, ожоги и т.д.).
24. Почему петарды нельзя запускать с балкона?
Петарды нельзя запускать с балкона во избежание их попадания в окна и на балконы рядом стоящих зданий.
29. Почему нельзя дотрагиваться до включенных электроприборов мокрыми руками?
Вода пропускает ток через себя. Это опасно для жизни.
25. Что нужно делать, если возник пожар в квартире?
Покинуть помещение и позвонить по телефону «01» или сотового «112» и сообщить адрес пожара, свою фамилию, что и где горит.
26. Чем можно тушить возгорание?
Водой, песком, землей (из цветочного горшка), стир. порошком, одеялом, пальто, огнетушителем.
27. Почему пожарная машина красного цвета?
Чтобы было видно издалека. Красный цвет привлекает внимание.
28. Какое главное правило при любой опасности?
Не поддаваться панике, не терять самообладания.
30. Чем опасен искрящий электрический провод?
Нарушение изоляции электрического провода может привести к поражению электрическим током, а повреждение токоведущей жилы – к искрению и возгоранию.
31. Почему ведра на пожарном щите ведра сделаны конусом?
Почему ведра на пожарном щите ведра сделаны конусом?
Это не связано с тем, чтобы помешать останавливаться на перерыв несущим воду на пожар, а потому, что конусом легче зачерпнуть и прицельно выплеснуть воду.
32. Почему при вызове пожарных надо сразу назвать адрес, а затем все остальное?
По адресу сразу будет направлена машина, а остальную информацию диспетчер передаст расчету по рации.
33. Какое одеяло можно использовать при тушении возгорания электроприбора?
Подойдет любая плотная ткань, в том числе телогрейка, но только из натуральных тканей, так как синтетика плавится c выделением едкого дыма.
34. Почему нельзя защемлять дверью или колесиками кресла провода?
Повреждаются мелкие жилки, из которых состоит провод, и возникает короткое замыкание.
35. За какое время выгорает помещение в блочном (панельном) доме?
Примерно за 10-15 минут, поэтому важно вовремя вызвать пожарных.
36. Как часто надо проверять и перезаряжать порошковые огнетушители?
1 раз в 5 лет.
37. В каком году было принято решение о создании в России спасательных служб?
В 1990 г создан Российский корпус спасателей на правах Государственного комитета, в 1994 г преобразован в МЧС России.
38. Какая древняя, но хорошо изученная ЧС природного характера, сопровождается пожарами и пеплом?
Разрушение древнеримского города Помпеи в результате извержения Везувия в 1 веке нашей эры.
39. Какой наградой была Московская пожарная охрана за годы Великой Отечественной войны?
Московская пожарная охрана была награждена орденом Ленина за героическую работу по тушению пожаров в годы ВОВ.
40. К какому ведомству относилась Пожарная охрана до создания МЧС?
Пожарная охрана до создания МЧС относилась к Министерство внутренних дел.
41. Что надо сделать при ожоге 2-ой степени с появлением пузырей?
Охладить под струей холодной воды, затем наложить сухую стерильную повязку и доставить в лечебное учреждение.
42. Можно ли поджигать прошлогоднюю траву?
Нельзя, так как огонь может распространиться и вызвать пожар, а также наносит вред многолетним растениям и живущим в земле насекомым, в том числе шмелям.
43. Как называется государственный нормативный документ, разъясняющий, как избежать пожара?
Правила пожарной безопасности.
44. На какие группы делятся пожары в зависимости от того, что горит?
На классы, обозначаемые латинскими буквами ABCDE.
45. В чем заключается принцип действия порошкового огнетушителя?
Порошок попадает на горящее вещество, спекается и изолирует его от притока кислорода воздуха.
46. На чем основан принцип действия углекислотного огнетушителя?
Эффект пламегашения достигается двояко: понижением температуры очага возгорания ниже точки воспламенения, и вытеснением кислорода из зоны горения негорючим углекислым газом — сжиженный диоксид углерода.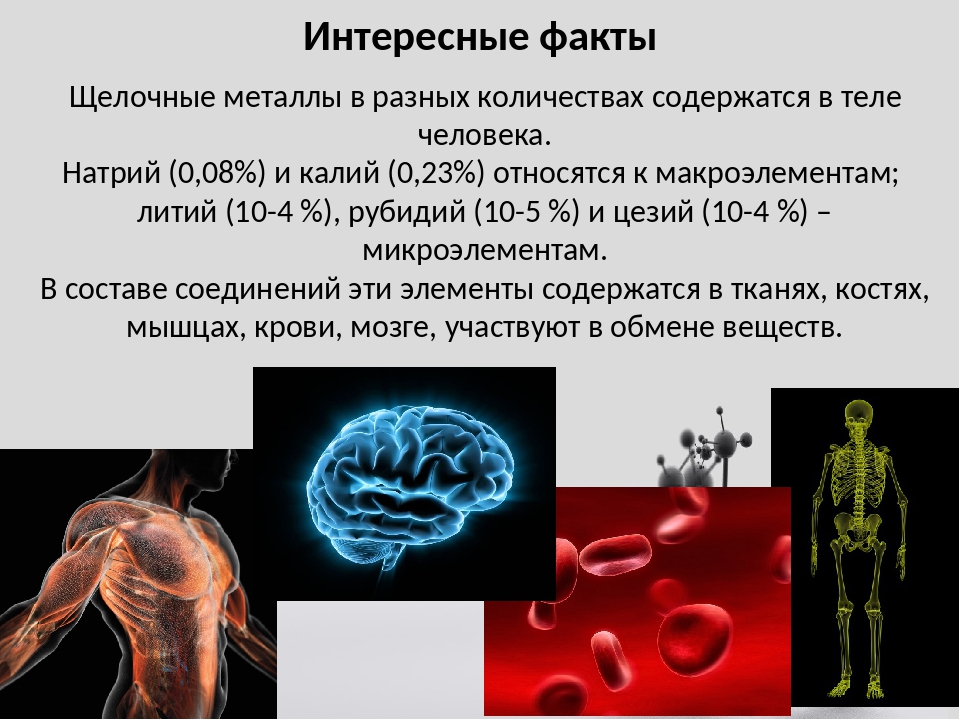
47. В чем состоит основное отличие самосрабатывающих огнетушителей?
Они реагируют на повышение температуры воздуха до определенной токи, после которой разрушается легкоплавкий предохранитель.
48. Можно ли тушить огнетушителем загоревшуюся на человеке одежду?
Нельзя, можно вызвать химические ожоги и усугубить заживление термических ожогов.
49. Что делать, если комната начала наполняться густым едким дымом?
Закрыть нос и рот мокрым носовым платком и продвигаться к выходу, прижимаясь к полу.
50. В каком году принят «Наказ о градском благочинии»?
В 1649 году по инициативе князя Алексея Михайловича Тишайшего
51. После какого года в России начали строить пожарные каланчи?
После 1803 года. 29 ноября 1802 года принимается Указ об организации в Санкт-Петербурге при съезжих дворах постоянной пожарной команды из 786 солдат внутренней стражи. Весной 1803 года команда была сформирована. В России началось строительство специальных зданий для пожарной команды.
В России началось строительство специальных зданий для пожарной команды.
52. Почему пожарные приветствуют разведение комнатных растений?
Там, где есть растения, всегда есть емкости с водой для полива, а землю можно использовать для тушения небольших очагов возгорания.
53. Почему пожарные не одобряют деревья на газонах под окнами зданий?
Деревья мешают установке пожарных лестниц.
54. Какие работы надо проводить в лесу постоянно для профилактики лесных пожаров?
Расчистка сухостоя и прокапывание противопожарных рвов.
55. Каковы пожароопасные последствия осушения болот?
Возгорание торфа.
56. Какие виды лесных пожаров существуют?
Низовой – когда горит сухая подстилка, кустарники, валежник. Верховой – когда горят сухостойные, а затем и живые деревья.
57. Если отрезало огнем в квартире на пятом этаже и нет телефона, что делать?
Мокрыми полотенцами, простынями заткнуть щели в дверном проеме, сократив приток дыма, через окно звать на помощь.
58. Почему нельзя бросать в костер аэрозольные баллоны из-под бытовой химии?
Они взрывоопасны.
59. Какая катастрофа произошла 26 апреля 1986 года, где первыми проявили свой героизм пожарные?
Катастрофа на Чернобыльской АС.
60. Где должны располагаться первичные средства пожаротушения на автостоянке, в поселке, на автозаправке, в гаражах?
Первичные средства пожаротушения должны располагаться на пожарном щите.
61. Какими огнетушителями пользуются при тушении возгораний в архивах, библиотеках, музеях?
Углекислотными. Они не портят (не смачивают, как водные, не разъедают, как пенные и не пачкают, как порошковые).
62. От чего чаще страдают на пожаре: от дыма или от огня?
От дыма, т.к. происходит отравление продуктами горения, потеря видимости.
63. Сколько суток продолжался пожар в Москве во время нашествия Наполеона?
5 суток
64. Назовите девиз пожарных на Руси?
Назовите девиз пожарных на Руси?
«Богу хвала, ближнему защита»
65. Какое самое главное правило при возникновении пожара?
Не паниковать и позвонить «01» или «112».
66. Почему пожарных называют огнеборцами?
Каждый день ведет бой с огнем, в котором могут погибнуть люди.
67. Что делать, если загорелся утюг?
1. Отключить электричество!
2. Накрыть тяжелой тканью и плотно прижать, чтобы не попал воздух.
68. Как называется наконечник на пожарном рукаве, направляющий водную струю?
Брандспойт или ствол пожарный.
Химические смеси: виды, названия, интересные факты | Моя Школа
Одним из основных аспектов химии является сочетание различных веществ. Иногда сочетание веществ может вызвать химическую реакцию и связь, что создает совершенно новое вещество, которое называют соединением. Однако иногда нету химической реакции или связи. В этом случае из комбинированных веществ образуется смесь.
В этом случае из комбинированных веществ образуется смесь.
Смесь изготавливают тогда, когда объединяются два или более веществ. Каждое вещество, содержащееся в смеси, называют компонентом. При их смешивании новое вещество не образуется. А чтобы узнать о других сочетаниях веществ, где происходит химическая реакция или связь, читайте учебник по химии за 7 класс О.В. Григоровича.
Общие свойства смеси:
Компоненты смеси можно легко отделить.
Каждый компонент сохраняет свои первоначальные свойства.
Доля компонентов изменчива.
Существуют однородные (гомогенные) и неоднородные (гетерогенные) смеси. В однородной смеси все вещества равномерно распределяются по всей смеси. Частицы других веществ в них невозможно обнаружить даже с помощью микроскопа (соленая вода, воздух, кровь).
В неоднородной смеси вещества не равномерно распределены (шоколадное печенье, пицца, масло в воде). Такие смеси формируют дисперсные системы. Компоненты дисперсных систем называют дисперсионной средой и дисперсной фазой.
Такие смеси формируют дисперсные системы. Компоненты дисперсных систем называют дисперсионной средой и дисперсной фазой.
К однородным смесям относятся смеси газов, растворы, сплавы, а к неоднородным – суспензии и коллоиды.
Растворы (однородные)Раствор – это смесь, где одно из веществ растворяется в другом. Вещество, которое растворяется, называется растворимым веществом. Вещество, которое не растворяется, называется растворителем.
Пример раствора – соленая вода. Эти компоненты можно легко отделить путем испарения, и каждый из них сохраняет свои первоначальные свойства. Однако соль равномерно распределяется в воде. В этом примере вода является растворителем, а соль – растворимым веществом.
Следует заметить, чтобы приготовить раствор, нужно газообразное, жидкое или твердое вещество смешать с растворителем (водой, спиртом, ацетоном).
Есть разница между раствором и смесью. В химии раствор – это тип смеси. Раствор – это смесь, которая одинакова или равномерная в течение всего времени. Смесь, которая не является раствором, не является равномерной в течение всего времени. Например, песок в воде – это гетерогенная смесь.
Смесь, которая не является раствором, не является равномерной в течение всего времени. Например, песок в воде – это гетерогенная смесь.
Сплав – это смесь элементов, которая имеет характеристику металла. По крайней мере один из смешанных элементов – это металл. Примером является сталь, которая изготавливается из смеси железа и углерода. Узнать о других сплавах можно в учебнике по химии 7 класс Г.А. Лашевской.
Суспензии (гетерогенные)Суспензия – это смесь жидкости или газа и частиц твердого вещества, которые не растворяются. Эти частицы «подвешены» в жидкости. Основная характеристика суспензии заключается в том, что твердые частицы со временем оседают и отделяются, если их оставить в покое.
Примером суспензии является смесь воды и песка. При смешивании песок будет рассеиваться по всей воде. Если его оставить в покое, песок оседает на дно.
Коллоиды (гетерогенные)Коллоид – это смесь, где очень маленькие частицы одного вещества равномерно распределяются по всему остальному веществу. Они выглядят очень похожими на растворы, но частицы суспендуються, а не полностью растворяются.
Они выглядят очень похожими на растворы, но частицы суспендуються, а не полностью растворяются.
Разница между коллоидом и суспензией заключается в том, что частицы в течение определенного периода пор не будут оседать на дне, они останутся взвешенными или плавающими.
Примером коллоида является молоко. Молоко – это смесь жидкого жира, рассеянного и суспендированного в воде. Коллоиды, как правило, считаются неоднородными смесями, но имеют и некоторые качества однородных.
Интересные факты о смесах:
Дым – это смесь частиц, что суспендуються в воздухе.
Вода из крана – это смесь воды и других частиц. Чистую воду или h3O обычно называют дистиллированной водой.
Многие вещества, с которыми мы сталкиваемся каждый день, – это смеси. Воздух, которым мы дышим, – это смесь газов, таких как кислород и азот.
Кровь – это смесь, которую можно разделить центрифугой на две ее основные части: плазму и эритроциты.

Смеси могут быть жидкостями, газами и твердыми веществами.
Не можете выполнить задание из учебника или рабочей тетради? Тогда вам в этом помогут ГДЗ и решебники по химии за 7 класс.
Химические элементы во Вселенной и в организме человека
Химические элементы во Вселенной и
в организме человека.
Для понимания структуры и эволюции Вселенной очень важен вопрос о химическом составе веществ во Вселенной. В естественном виде на Земле встречается около 90 разных видов атомов, остальные — получены искусственно.
Все мы знаем, что простейший элемент водород наполняет нашу Вселенную на 75%.
Его символом в таблице Менделеева является H, его атомное число — 1. Именно водород — своеобразная «точка отсчета», «химическая единица».
Но знаете ли вы, какие еще есть химические элементы, не менее важные для нашего существования и играющие значительную роль для жизни людей, животных, растений и всей нашей Земли? Элементы из этого рейтинга формируют всю нашу Вселенную!
1. Водород.
Водород.
2.Гелий. На его долю приходится 23% космической массы. Это инертный газ без запаха и цвета, самый легкий после водорода.
3.Кислород. Газ без вкуса, цвета и запаха, входящий в состав воздуха (23%) и необходимый для дыхания. Самый распространённый элемент земной коры -49%.
4.Неон. Инертный газ, без цвета и запаха. Присутствует в атмосфере (0,0018% объема). Применяют в газоразрядных источниках света неоновых лампах и газосветных трубках (красное свечение).
5.Азот. Газ, без цвета, вкуса и запаха; составляет 4/5 (79 %) воздуха; составная часть многих растительных и животных веществ.
6.Углерод. Неметалл. Содержание в земной коре сравнительно невелико (0,14% по весу). Основные кристаллические модификации алмаз и графит. Химический элемент, являющийся важнейшей составной частью всех органических веществ в природе.
7. Кремний. Неметалл, известны аморфный и кристаллический кремний. Второй после кислорода по распространенности на Земле элемент, содержание в земной коре 27,6% по массе.
Кремний. Неметалл, известны аморфный и кристаллический кремний. Второй после кислорода по распространенности на Земле элемент, содержание в земной коре 27,6% по массе.
8.Магний. Серебристый металл, очень легкий и прочный. Применяется в тепловой и ядерной энергетике.
9.Железо. Самый распространенный в природе тяжелый металл серебристого цвета. С примесью разных количеств углерода, образует сталь и чугун.
10.Сера. Твердое вещество желтого цвета; в природе встречается как в свободном виде, так и в виде различных соединений. Универсальное дезинфицирующее средство.
Каждому человеку будет интересно узнать интересные факты о водороде:
1. Водород — самый легкий, самый простой и самый распространенный химический элемент во Вселенной.
2. В больших количествах водород обнаружен в звездах и планетах типа «газовый гигант». Он играет ключевую роль в протекающих в звездах реакциях синтеза.
Он играет ключевую роль в протекающих в звездах реакциях синтеза.
3. Водород является одним из двух элементов, из которых состоит вода (H2O). Каждая молекула воды содержит два атома водорода и один атом кислорода.
4. В 1783 году водород получил свое имя. Слово «гидроген» происходит из греческого языка и состоит из слов «гидро» (означающего воду) и «генез» (означающего рождение). Гидро- (водо-) ген (род) — порождающий воду.
5. Водород является газом с молекулярной формулой H2. При комнатной температуре и нормальном давлении водород является безвкусным, бесцветным и лишенным запаха газом.
6. Под давлением и при сильном холоде (-252,87 градусах по Цельсию) водород переходит в жидкое состояние. Хранимый в этом состоянии водород занимает меньше места, чем в своей «нормальной» газообразной форме. Жидкий водород используется в том числе и в качестве ракетного топлива.
7. При сверхвысоком давлении водород переходит в твердое состояние и становится металлическим водородом.
8. Водород используется в качестве альтернативного топлива для транспорта. Химическая энергия водорода высвобождается при его сжигании способом, подобным тому, который применяется в традиционных двигателях внутреннего сгорания. На его основе также создаются топливные элементы, в которых задействован процесс образования воды и электричества путем осуществления химической реакции водорода с кислородом.
9. Молекулярная формула перекиси водорода H2O2. Это вещество часто используется для отбеливания волос и в качестве чистящего средства. В виде медицинского раствора оно используется также для обработки ран.
10. Водород широко применяется в нефтяной и химической отраслях, а также часто используется для различных физических и инженерных задач: например, в сварочном деле и в качестве охлаждающего вещества.
11. Водород потенциально опасен для человека, поскольку может возгораться при соприкосновении с воздухом. Кроме того, этот газ не годится для дыхания.
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ В ОРГАНИЗМЕ ЧЕЛОВЕКА
Многим химикам известны крылатые слова, сказанные в 40-х годах текущего столетия немецкими учеными Вальтером и Идой Ноддак, что в каждом булыжнике на мостовой присутствуют все элементы Периодической системы. Вначале эти слова были встречены далеко не с единодушным одобрением. Однако, по мере того как разрабатывались все более точные методы аналитического определения химических элементов, ученые все больше убеждались в справедливости этих слов.
Если согласиться с тем, что в каждом булыжнике содержатся все элементы, то это должно быть справедливо и для живого организма. Все живые организмы на Земле, в том числе и человек, находятся в тесном контакте с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствуют питание и потребляемая вода.
Поступлению в организм химических элементов способствуют питание и потребляемая вода.
Организм человека состоит на 60% из воды, 34% приходится на органические вещества и 6% — на неорганические.
Основными компонентами органических веществ являются углерод, водород, кислород, в их состав входят также азот, фосфор и сера. В неорганических веществах организма человека обязательно присутствуют 22 химических элемента: Ca, P, O, Na, Mg, S, B, Cl, K, V, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cr, Si, I, F, Se.
Например, если вес человека составляет 70 кг, то на долю металлов приходится 2,1 кг: кальция – 1700 г, калия – 250 г, натрия – 70 г, магния – 42 г, железа – 5 г, цинка – 3 г. Остальное приходится на микроэлементы.
В человеческом организме можно найти все химические элементы, вплоть до золота, а также, к сожалению, и элементы радиоактивного распада. Без этой «таблицы Менделеева» мы не сможем жить, мы будем себя плохо чувствовать и даже болеть, если каких–то элементов будет не хватать. Впрочем, также плохо нам будет, если элементы окажутся в избытке.
Впрочем, также плохо нам будет, если элементы окажутся в избытке.
Все химические элементы организма делятся на две группы: макро- и микроэлементы. К макроэлементам относятся элементы с концентрацией в организме более 0, 001%: кислород, углерод, водород (10,5%), железо, калий (0,27%), кальций (1,4%), магний (0,04%), натрий (0,26%), азот.
Углерод, водород, кислород и азот – это четыре элемента, которые иногда называют «китами химии», «элементами жизни». Из атомов этих 12 элементов построены не только живые белки, но и вся природа вокруг нас. К микроэлементам относят элементы, доля которых в организме составляет от 0,001 до 0,000001%. Это цинк, йод, кобальт, хром, медь и др. Если концентрация элементов в организме еще меньше, то их относят к группе следовых (т.е. в организме обнаружены его следы). Это селен, бор, серебро, золото и др. Кроме того, во всех организмах находится небольшое количество тяжелых металлов. 15 химических элементов (железо, йод, медь, цинк, кобальт, хром, молибден, никель, ванадий, селен, марганец, мышьяк, кремний, литий) признаны эссенциальными, т.е. жизненно необходимыми. Четыре других (кадмий, свинец, олово, рубидий) являются серьезными кандидатами на эссенциальность. Экспериментально установлено, что в организме человека металлы составляют около 3% (по массе). Это очень много.
15 химических элементов (железо, йод, медь, цинк, кобальт, хром, молибден, никель, ванадий, селен, марганец, мышьяк, кремний, литий) признаны эссенциальными, т.е. жизненно необходимыми. Четыре других (кадмий, свинец, олово, рубидий) являются серьезными кандидатами на эссенциальность. Экспериментально установлено, что в организме человека металлы составляют около 3% (по массе). Это очень много.
Для того чтобы организм функционировал и в его работе не происходили сбои необходимо позаботиться о регулярном достаточном поступлении в него необходимых макро — и микроэлементов.
Интересные факты о воде для школьников | NUR.KZ
Вода: UnsplashВода — уникальное вещество, благодаря которой на Земле существует все живое. Мы используем ее ежедневно и не задумываемся о ее необычных свойствах. Раскроем самые интересные тайны воды.
Удивительные физические и химические свойства воды
Какие интересные факты о физических свойствах воды? Удивительно, но даже сведения о том, что вода замерзает при 0 °C и испаряется при 100 °C, регулярно опровергаются учеными. Вот несколько невероятных открытий, связанных с водой:
Вот несколько невероятных открытий, связанных с водой:
- В любом школьном учебнике написано, что вода имеет три состояния — твердое, жидкое и газообразное. Однако в течение последних 30 лет ученые стали задумываться, что этих состояний может быть больше. Некоторые из них могут иметь несколько совершенно разных форм. Так, в 2020 году международная команда ученых доказала, что вода может существовать в виде двух жидкостей разной плотности. Благодаря этому они при определенных условиях не смешиваются друг с другом. Между ними остается тонкая граница раздела, как, например, между обычной водой и нефтью.
- Горячая вода замерзает быстрее, чем холодная. Это явление называется «парадокс Мпембы» — в честь обычного школьника Эрасто Мпембы, который впервые заметил этот эффект. Наука до сих пор не может с точностью ответить на вопрос, почему так происходит. Однако эксперименты и исследования подтверждают правдивость парадокса.
- Вода может оставаться жидкой при температуре ниже 0 °C.
 Таким свойством наделена сверхчистая вода без примесей (именно вокруг них образуется кристаллизация). Даже при температуре –40 °C она не превращается в лед и становится сверхохлажденной.
Таким свойством наделена сверхчистая вода без примесей (именно вокруг них образуется кристаллизация). Даже при температуре –40 °C она не превращается в лед и становится сверхохлажденной.
Если кристаллизацию спровоцировать, можно наблюдать, что вода мгновенно превратится в лед.
Вода: UnsplashКакие интересные факты о химических свойствах воды? Формула воды всем известна — Н₂О. Но факт в том, что вода с таким составом существует разве что на бумаге. Поскольку она природный растворитель, то в ней всегда есть множество примесей. Каких именно — зависит от ее происхождения. Итого в мире насчитывают более тысячи различных видов воды.
Начнем с того, что на планете есть соленая и пресная вода. Вторая составляет лишь 3% от всего объема. Из нее только треть пригодна для питья, а остальная хранится в ледниках.
Любопытно, что выпивая один стакан воды, человек поглощает около 8 септиллионов молекул — это число с 24 нулями.
Взаимодействие воды и человека
Без воды невозможно существование живых организмов. Человек сам на две трети состоит из воды и может прожить не более 5 дней, не пополняя ее запасы.
Человек сам на две трети состоит из воды и может прожить не более 5 дней, не пополняя ее запасы.
Какие интересные факты о взаимодействии человека с водой? Назовем некоторые из них:
- С возрастом количество воды в организме человека уменьшается. В младенчестве ее доля может достигать 86%, а к старости сократится до 50%.
- Человек ощущает сильную жажду, когда теряет 2% воды от массы своего тела. Если потерять до 10%, то начнутся галлюцинации, а потерю 12% можно восстановить только с помощью врача. Сокращение воды в организме на 20% приводит к неминуемой гибели.
- Мы не представляем свой быт без воды. Благодаря техническому прогрессу можем не задумываться, когда расходуем ее ежедневно. Цифры говорят о том, что в Средние века одна семья тратила не более 5 л воды в день. Сейчас это количество может достигать 1000 л. Наибольшее количество воды расходуется на смыв в туалете.
- Вода — источник здоровья, красоты и долголетия, но не всегда.
 Поскольку она превосходный природный растворитель, то растворяет и ядовитые вещества, поэтому становится переносчиком болезнетворных бактерий. Так, 85% болезней в мире передается именно через воду. Из-за плохой воды в мире каждые 8 секунд умирает один человек.
Поскольку она превосходный природный растворитель, то растворяет и ядовитые вещества, поэтому становится переносчиком болезнетворных бактерий. Так, 85% болезней в мире передается именно через воду. Из-за плохой воды в мире каждые 8 секунд умирает один человек. - По оценкам Всемирной организации здравоохранения, лишь 71% населения планеты имеет доступ к безопасной воде. По меньшей мере миллиард человек не имеет свободного доступа к источнику чистой воды. В мире за последние полвека из-за нее произошло более 500 конфликтов, 21 из них перерастал в военные действия.
Самая чистая вода на планете в Финляндии. За ней следует Канада, Новая Зеландия и Великобритания.
Самый удивительный факт о воде состоит в том, что это крайне редкий ресурс. Со временем доступ к пресной питьевой воде будет сокращаться. Однако ученые продолжают исследовать ее природу, открывая все новые невероятные свойства и альтернативные способы ее добычи.
Оригинал статьи: https://www. nur.kz/family/school/1602924-interesnye-fakty-o-vode/
nur.kz/family/school/1602924-interesnye-fakty-o-vode/
46 реактивных фактов о химии
Химия — это жизнь. Или жизнь химия? Давайте просто согласимся на оба пункта. Можете ли вы уже перечислить периодическую таблицу по атомному весу или ожидали список о Райане Гослинге и Рэйчел МакАдамс в Записной книжке (понятно? У них была отличная химия!), вам предстоит многое узнать об этой увлекательной отрасли науки. . Вот 46 самых интересных фактов о химии и ее роли в нашей жизни.
46.Корпус карандаша
В вашем теле, да, в вашем, достаточно графита, чтобы произвести примерно 9000 карандашей. Видишь ли, ты особенный в конце концов.
45. Подушка безопасности
Подушки безопасности в автомобилях могут спасти вам жизнь, но на самом деле они сделаны из высокотоксичного вещества, называемого азидом натрия. Подушка безопасности полна этих солей, и они высвобождаются при срабатывании автомобиля для повышения их температуры, чтобы вырвать подушку из ее компактного места. Однако не беспокойтесь, так как после этой доли секунды повышения температуры они превращаются в газообразный азот, что фактически заставляет подушку безопасности расширяться.
Однако не беспокойтесь, так как после этой доли секунды повышения температуры они превращаются в газообразный азот, что фактически заставляет подушку безопасности расширяться.
44. Одна шина, одна молекула
Шины — это гигантские куски резины, поэтому кажется, что они должны состоять из множества разных молекул. Однако резиновые шины на самом деле состоят из одного массивного звена цепи полимеров, что делает их одной единственной молекулой.
43. Снег в воду
Старая легенда о том, что один дюйм воды равен 10 дюймам снега, верна, но не всегда. Это соотношение верно для случая, когда идет снег при температуре 30 градусов по Фаренгейту, но соотношение увеличивается при понижении температуры и уменьшается при повышении температуры.Например, при 20 градусах соотношение составляет 20 дюймов снега к одному дюйму дождя, а при 40 градусах оно составляет 5:1.
42. Магическое расширение
Вода особенная, и мы все это знаем, даже если в детстве вы прогуливали уроки. Когда вода замерзает, она, очевидно, расширяется, но если подумать, это не должно быть так очевидно. Как правило, материалы уплотняются и сжимаются при понижении температуры, но вода и ее уникальная структура имеют много места для высвобождения энергии, что приводит к ее расширению.
Когда вода замерзает, она, очевидно, расширяется, но если подумать, это не должно быть так очевидно. Как правило, материалы уплотняются и сжимаются при понижении температуры, но вода и ее уникальная структура имеют много места для высвобождения энергии, что приводит к ее расширению.
41. Замороженный
Интересно, что вода быстрее замерзает, когда она теплая, а не холодная.
40. Чувствуете запах?
Нет ничего лучше свежего, чистого запаха после хорошей грозы. Это связано с химической реакцией молнии на землю при ударе. Когда ударяет молния, она создает озон — да, тот самый озон, кислородное соединение, которое защищает землю, — расщепляя молекулы кислорода, которые затем преобразуются в озон и выделяют в воздух стойкий запах.
39. Водяные младенцы
Взрослые люди обычно примерно на 60% состоят из воды, однако при рождении мы состоим из воды почти на 80%. После года содержание воды падает до 65%, а по мере взросления ребенка стабилизируется на уровне 60%.
38. Не пытайтесь повторить это дома
Допустим, у вас есть комната с деревянными стенами, и она нагрета до 68 градусов по Фаренгейту. Вы также используете электрическую дрель, чтобы просверлить стену, пытаясь поджечь дом.Без проблем. Ваша дрель потребляет в среднем 750 Вт электроэнергии, а для нагрева килограмма древесины требуется 2000 Дж энергии, поэтому для достижения желаемого эффекта потребуется всего четыре минуты непрерывного сверления. Вуаля! Вы можете получить деньги по страховке.
Самые увлекательные истории и самые темные секреты истории, ежедневно доставляемые на ваш почтовый ящик. Делаем отвлечение полезным с 2017 года.
37. Естественное отопление
Или, как насчет того, чтобы ничего не поджигать.Вместо этого просто нагрейте свой дом с людьми! Это легко, так как люди излучают в среднем около 150 ватт, потребуется всего 70 человек, чтобы согреть ваш дом зимой, если вы держите их в постоянном движении. У вас нет 70 человек? Ну а для чего еще Facebook? Создайте это приглашение на мероприятие!
36.
 Медный фильтр
Медный фильтрЕдинственным металлом, обладающим природными антибактериальными свойствами, является медь. Так что да, медная бутылка для воды, которую ваш друг повсюду носит с собой, имеет научное обоснование.
35. Папа
«Отец» таблицы Менделеева — Дмитрий Менделеев. Он создал периодическую таблицу элементов, по сути, как гигантскую шпаргалку. Работая профессором Санкт-Петербургского государственного университета, он должен был представить описание всех химических элементов, но времени было мало, поэтому он просто набросал большой набор данных об атомном весе. Вот почему таблица упорядочена по атомному весу.
34. Спорный химик
Менделеев был неоднозначной фигурой при жизни.Его второй брак вызвал общественный спор, потому что его развод еще не был завершен, а в Императорской России нужно было развестись в течение семи лет, прежде чем они могли снова жениться, что делало его брак незаконным. Из-за этого Российская академия наук отказала ему в приеме, хотя он отвечал за преобразование русской химии.
33. Пусть растет
Бритье — отстой. Мы все это знаем, но не у многих из нас хватает смелости просто сказать: «К черту все, я отращиваю все свое тело».Но Дмитрию Менделееву было все равно, и известно, что он подстригает бороду только раз в год, каждую весну. Когда его вызвали к российскому царю, он даже не удосужился привести себя в порядок.
32. Закон о химиках
Менделеев создал Периодический закон, в котором он описал основную закономерность всех 63 известных элементов того времени. Он использовал это, чтобы создать таблицу, которая затем предвосхищала новые элементы, имея пробелы, создавая новую расу, чтобы обнаружить, какие элементы отсутствовали в банке человеческих знаний.
31. Эго на пути
Менделеев затем использовал это пустое пространство для предсказания еще не открытых элементов и даже для предсказания их веса и химического поведения. Однако это также побудило его отрицать существование элементов, которых он не предвидел, как он сделал с открытием аргона, галлия, скандия и германия, просто потому, что они не умещались в его таблице.
30. Ведро для кеты
Мел — неотъемлемая часть детства, от школы до игры на тротуаре, и вы наверняка пробовали его когда-нибудь.Это было не очень хорошо, не так ли? Он чертовски сух, и это может иметь какое-то отношение к его составу: он состоит из триллионов окаменелого планктона. Возможно, это часть плана Шелдона Дж. Планктона по краже рецепта крабсбургера.
29. Тушить огонь спермой
В качестве природного антипирена ДНК в настоящее время используется для создания огнестойких волокон. Продолжается исследование того, как заменить коммерческие антипирены этой естественно повторяющейся, экологически чистой структурой, из которой состоит вся жизнь на Земле.
28. Рубашки со спермой
Один из способов проведения экспериментов с ДНК заключается в покрытии хлопчатобумажной ткани ДНК, извлеченной из спермы сельди. Ммм, как привлекательно.
27. Спасибо, Слюна
Еда – это необходимость, однако вкусная еда – одно из величайших удовольствий в жизни. Вы можете благодарить за это свою слюну, так как без этой влаги вы ничего не смогли бы почувствовать на вкус. Слюна расщепляет пищу, которая, в свою очередь, растворяет химические вещества на вкусовых рецепторах языка.
Вы можете благодарить за это свою слюну, так как без этой влаги вы ничего не смогли бы почувствовать на вкус. Слюна расщепляет пищу, которая, в свою очередь, растворяет химические вещества на вкусовых рецепторах языка.
26. Как легко ты можешь идти
Самый легкий элемент, состоящий исключительно из радиоактивных изотопов технеция, который также является первым искусственно созданным элементом. Однако у технеция нет даже одного стабильного изотопа. Поскольку это был первый в основном искусственный элемент, добавленный в периодическую таблицу, его название происходит от греческого слова «искусственный».
25. Тяжело получается
Самый тяжелый элемент в мире — Оганесон. Этот синтетический элемент, впервые задуманный в 1979 году и получивший условное название Ununoctium, был окончательно разработан и признан в 2016 году.После его синтеза он был переименован в честь известного физика-ядерщика Юрия Оганесяна.
24. Нет, мы были первыми
Оганесян — один из двух периодических элементов, названных в честь живого человека, а второй — сиборгий, еще один синтетический элемент, известный как самый стабильный изотоп. Атомы этого элемента были обнаружены как советскими, так и американскими учеными в 1974 году, что привело к спору между двумя странами, который продлится 23 года.
Атомы этого элемента были обнаружены как советскими, так и американскими учеными в 1974 году, что привело к спору между двумя странами, который продлится 23 года.
23.Металлический стол
Металл — самый распространенный тип элемента в периодической таблице. Интересно, что только два несеребряных металла — это золото и медь.
22. Наполнение воздушного шара
Helium обладает способностью не только повышать голос, но и повышать сам себя. Будучи легче кислорода, воздух вокруг нас дает ему возможность плавать.
21. Истоки нашего происхождения
Хотя углерод есть везде, даже внутри звезд, он не образовался в результате Большого Взрыва.Вместо этого атомы углерода производятся атомами гелия, которые сливаются во время образования красных гигантов умирающими звездами.
20. Создание гиганта
Красные гиганты приобретают свой цвет, или, по крайней мере, цвет, воспринимаемый человеческим глазом, в процессе охлаждения и расширения, когда весь их водород окончательно израсходован. Это произойдет с нашим солнцем примерно через 5 миллиардов лет, и в процессе оно поглотит Меркурий и Венеру.
Это произойдет с нашим солнцем примерно через 5 миллиардов лет, и в процессе оно поглотит Меркурий и Венеру.
19. Алмазные слезы
Слово «углерод» происходит от французского слова «уголь» — уголь.Он был назван в 18 веке после того, как Антуан Лавуазье выяснил, что алмаз состоит из углерода. Он сделал это, создав инструмент для фокусировки солнечных лучей (солнечная печь), а затем использовал его для сжигания алмаза и анализа остатка. Только тогда люди поняли, что углерод — это не просто уголь, а уникальное химическое вещество.
18. Макияж человека
В мире существует 94 встречающихся в природе химических элемента, и наши тела состоят из более чем 60 из них. Они необходимы для нашего строения, но только шесть из них составляют 99% нас: кислород, углерод, водород, азот, кальций и фосфор.
17. Горячий лед
Мы называем бриллианты «льдом» из-за их внешнего вида, верно? Неправильный. На самом деле, «лед» — это не просто сленг, за ним стоит реальная логика. Алмазы обладают способностью переносить тепло, что, в свою очередь, делает их ледяными на ощупь. Уникальная теплопроводность обусловлена трехмерной переплетенной решетчатой структурой их состава, которая превращает тепло в легко переносимые колебания решетки.
Алмазы обладают способностью переносить тепло, что, в свою очередь, делает их ледяными на ощупь. Уникальная теплопроводность обусловлена трехмерной переплетенной решетчатой структурой их состава, которая превращает тепло в легко переносимые колебания решетки.
16. Углерод как одеяло
То, что что-то становится модным словом и используется в качестве политической риторики, не всегда означает, что вы должны относиться к этому скептически.Химическая наука, стоящая за нагреванием нашей планеты и последующим изменением климата, относительно проста: углекислый газ прочно окружает планету Земля, предотвращая утечку слишком большого количества тепла, и таким образом создает теплые условия, поддерживающие жизнь. По мере того как люди сжигают все больше и больше ископаемого топлива, все больше углекислого газа выбрасывается в атмосферу, и планета поглощает все больше тепла. Ну, объясни это своему дяде на День Благодарения, и, может быть, на этот раз он поймет.
15.
 Специальный пылесос
Специальный пылесосДля того, чтобы закипеть, воде нужна среда особого давления, но не обязательно очень высоких температур. На самом деле, хотя в космосе невероятно холодно, вода в космосе закипает. Первое, что происходит при воздействии космического вакуума, — быстрое кипение, за которым следует мгновенное замерзание.
14. Писает в космосе
Как мы выяснили странное поведение воды в космосе? Самый естественный способ, конечно: помочиться. Астронавты заметили, что когда они справляли нужду в космических условиях, моча бурно кипела, а затем подвергалась сублимации, так как ее пары сразу затвердевали.В результате в космосе появилось облако замороженной мочи.
13. Тальк повсюду
Все знают тальк — он вездесущ в современном обществе. Это связано с тем, что тальк является самым мягким известным химическим веществом, что делает его идеальным для всего: от сушки рук баскетболистов до смазывания вещей.
12. Высушенный
Сухой лед… ну, собственно, что такое сухой лед? Это углекислый газ в твердом состоянии. Это и есть.
Это и есть.
11. Жидкие мечи
Хотя металл является твердым телом, не каждый металл является твердым при комнатной температуре.Ртуть — это единственный металл, который на самом деле принимает другую форму при нормальных условиях, вплоть до 0 градусов по Цельсию.
10. Кислородные краски
Кислород прозрачен для человеческого глаза, однако при переходе в жидкое состояние приобретает синий цвет.
9. Кожа лягушки
Кожа человека содержит белки, которые делают нас водонепроницаемыми, чтобы вода не вытекала из нашего тела, что также ограничивает наше поглощение внешней воды. Лягушке же не нужно даже пить воду, так как ее кожа поглощает воду из воздуха.
8. Машины для созревания
Вы когда-нибудь замечали, что когда начинают созревать яблоки, другие фрукты и овощи вокруг них тоже начинают созревать? Нет, я не просто так это выдумал — обратите внимание на свою вазу с фруктами! Ну, это потому, что когда яблоки созревают, они выделяют газ этилен, который способствует созреванию многих различных видов свежих продуктов. Таким образом, для тех из нас, кто живет в более холодном климате, вы можете держать свои яблоки рядом с твердыми зелеными комочками, которые в продуктовых магазинах называют авокадо, когда вы распаковываете свои продукты.
Таким образом, для тех из нас, кто живет в более холодном климате, вы можете держать свои яблоки рядом с твердыми зелеными комочками, которые в продуктовых магазинах называют авокадо, когда вы распаковываете свои продукты.
7. Ржавчина
Марс кажется нам красным из-за обилия оксида железа. Другое слово для этого: ржавчина. Марс — это большой старый ржавый шар, парящий в космосе.
6. Разбивающееся стекло
Металлы состоят из плотно упакованных атомов, однако стекло, в отличие от других твердых материалов, содержит случайный набор атомов, которые относительно свободны друг от друга и широко рассеяны. Из-за такого состава стекло не может поглощать энергию, так как атомы находятся недостаточно близко, чтобы поддерживать его структуру при передаче энергии, что делает его очень хрупким.
5. Посредничество
Стекло на самом деле не находится в твердом состоянии, а находится в так называемом аморфном твердом состоянии, что означает материал, который не является твердым, но и не жидким. Что это значит? Это означает, что стекло – это своего рода жидкость, которая живет своей жизнью, неторопливо течет.
Что это значит? Это означает, что стекло – это своего рода жидкость, которая живет своей жизнью, неторопливо течет.
4. Основа физической жизни
Углерод является основой всей жизни на Земле, так как он может связываться со многими другими химическими элементами, но он также может связываться сам с собой и впоследствии может принимать множество различных физических форм, включая алмазы и графит — одни из самых твердых и самых мягких вещества земли.
3. Как солено
Закон Архимеда положил начало тому, что когда вы входите в ванну, уровень воды тут же поднимается. Тем не менее, когда вы добавляете в воду саму соль, уровень соли в воде на самом деле снижается, так как растворяющиеся ионы в воде позволяют молекулам растворителя лучше упорядочиваться.
2. Сокращение калорий
Точно так же, если вы добавите пол-литра спирта в пол-литра воды, вы получите менее одного литра общей жидкости.Просто еще один пример чуда алкоголя. Пожалуйста.
1.
 Слишком богат для моей крови
Слишком богат для моей кровиСтартап из Оксфордского университета разработал тип молекулы, называемой эндоэдральным фуллереном , также известным как «бакибол». Эти молекулы продаются по цене, эквивалентной 167 миллионам долларов за грамма . Единственное более дорогое вещество? Это мифическое вещество, известное как антиматерия. Ученым действительно удалось произвести некоторые вещества, но целый грамм антиводорода стоил бы 62 доллара.5 трлн .
Источники: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23
10 увлекательных и забавных научных фактов об атомах
10 увлекательных и забавных научных фактов об атомах
октябрь 2018 г.
Как много вы знаете об атомах? Проверьте свои знания с помощью этих увлекательных фактов.
- Все во Вселенной состоит из атомов. Они являются основными строительными блоками всех типов материи во Вселенной.

- Атомы невероятно малы, их диаметр составляет одну десятую миллиардной метра. Они настолько малы, что их не видно даже под мощным микроскопом. Из-за того, что они такие маленькие, для создания чего-либо требуются триллионы атомов, например, в вашем теле 7 миллиардов миллиардов миллиардов атомов.
- Атом состоит из более мелких частиц, называемых субатомными частицами. Эти субатомные частицы — электроны, протоны и нейтроны.
- Существует более 100 различных видов атомов — 92 природных и 8 искусственных.Различные виды атомов основаны на количестве электронов, протонов и нейтронов. Атомы также могут изменяться в результате химических реакций и объединяться в молекулы.
- Различные типы и количество атомов соединяются вместе, образуя разные элементы, и комбинируются по-разному, создавая разные типы материи, каждый из которых имеет свое уникальное количество протонов, нейтронов и электронов.
- В центре атома находится ядро, состоящее из протонов и нейтронов.
 Ядро чрезвычайно плотное и содержит всю массу атома. Поскольку ядро так трудно расщепить, атомы могут существовать вечно.
Ядро чрезвычайно плотное и содержит всю массу атома. Поскольку ядро так трудно расщепить, атомы могут существовать вечно. - Нейтроны не имеют заряда. Количество нейтронов в ядре играет важную роль в определении массы атома и радиоактивности.
- Протоны — положительно заряженные частицы в ядре атома. Каждый элемент в природе или созданный в лаборатории имеет по крайней мере один протон. Масса протона такая же, как у нейтрона, но в 1840 раз больше массы электрона.
- Электроны — это отрицательно заряженные частицы, вращающиеся вокруг ядра снаружи. Они вращаются так быстро, что ученым бывает трудно их наблюдать. Их притягивает положительный заряд протонов, и они являются мельчайшими частицами в атоме — в протон можно поместить 2000 таких частиц.
- Атом в основном представляет собой пустое пространство. Каждый атом на 99,9% состоит из пространства, потому что электроны вращаются так далеко от ядра.
Хотите узнать больше об атоме? Чтобы получить больше науки, больше удивительных фактов и больше удовольствия, запишитесь сейчас в наши научные лагеря и классы, где дети могут учиться, экспериментировать, исследовать и играть!
Департамент образования штата Оклахома
Академические стандарты Оклахомы для науки
Академические стандарты штата Оклахома для науки были приняты в 2020 году.
Разработка и пересмотр стандартов
В группы авторов и черновиков входили преподаватели K-12, представители высших учебных заведений, ученые, инженеры, родители и члены сообщества со всего штата, которые разработали стандарты и предоставили отзывы о стандартах, встречаясь несколько раз. Сотни педагогов по всему штату участвовали в пересмотре стандартов. Чтобы узнать больше о процессе обзора и пересмотра, перейдите сюда.
Добро пожаловать на стартовую площадку для получения информации, связанной с научным образованием студентов из Оклахомы.Темы страницы
Научные стандарты | Ресурсы | Профессиональное развитие | Часто задаваемые вопросы | Программы
Академические стандарты Оклахомы для науки
Новые Академические стандарты штата Оклахома по естественным наукам (OAS-Science) были приняты в мае 2020 года. Школы могут начать внедрение новых стандартов в 2020–2021 учебном году. Однако государственные оценки для 5-го, 8-го и старшего классов не будут приведены в соответствие с научными стандартами 2020 года до 2022–2023 годов, что предоставит школам трехлетний график внедрения.
Однако государственные оценки для 5-го, 8-го и старшего классов не будут приведены в соответствие с научными стандартами 2020 года до 2022–2023 годов, что предоставит школам трехлетний график внедрения.
Оценки по естественным наукам на 2020–2021 и 2021–2022 годы будут приведены в соответствие с Академическими стандартами науки Оклахомы 2014 года и будут проводиться в 5, 8 и 11 классах. Академические стандарты Оклахомы для науки 2020 года будут оцениваться, начиная с 2022–2023 годов.
Подключайтесь к OKScience PLN
Выделенный PD в вашем плане
| Ресурсы | |
|---|---|
Научные оценки | В 2020–2021 и 2021–2022 годах научные оценки будут по-прежнему приведены в соответствие с Академическими стандартами штата Оклахома 2014 года для науки (скачать).Академические стандарты Оклахомы для науки 2020 года начнут оцениваться в 2022–2023 годах. |
| Оклахома, страница внедрения науки | Найдите такие ресурсы, как Научные рамки Оклахомы, Научные PD в модулях вашего плана и дополнительные ресурсы, соответствующие Академическим стандартам Оклахомы для науки. |
Национальная ассоциация преподавателей естественных наук | Национальная ассоциация преподавателей естественных наук — это организация, которая поддерживает научное образование по всей стране.С NSTA вы найдете ведущие ресурсы для передового опыта в преподавании и обучении и опыт роста за счет надежного профессионального развития. |
Ассоциация преподавателей естественных наук Оклахомы | Ассоциация преподавателей естественных наук Оклахомы — это профессиональная ассоциация штата, специально занимающаяся интересами и заботами учителей естественных наук.Помимо получения регулярных информационных бюллетеней (теперь исключительно через этот блог OSTA), члены OSTA имеют право участвовать в ежегодной осенней конференции OSTA в качестве докладчиков и участников. |
Наверх
| Профессиональное развитие | |
|---|---|
| PD В вашем плане | PD on Your Plan — это попытка предоставить педагогам возможность профессионального развития в небольших предложениях, которые могут быть выполнены учителем в период их плана, группой учителей во время собрания кафедры или группой преподавателей во время преданного профессионального учебного сообщества ( ПЛК) время. Серия PD по модулям вашего плана была разработана, чтобы помочь преподавателям понять Академические стандарты штата Оклахома для науки и три измерения науки, включенные в стандарты. |
| Открытые образовательные ресурсы для PD | Инструменты обучения STEM предлагают широкий спектр открытых образовательных ресурсов для профессионального развития по стандартам трехмерной науки.Доступны сеансы продолжительностью от 30 минут до нескольких дней. Эти сеансы PD обеспечивают несколько точек входа, независимо от того, на каком уровне понимания Академических стандартов Оклахомы находится учитель. Обзор сессии: использование научной аргументации в классе Практика аргументации, то есть разработка, исследование, анализ и уточнение линий рассуждений и объяснений способами, основанными на фактических данных, необходима для работы ученых, а также для научного мышления и обучения.Этот краткий курс предназначен для того, чтобы помочь преподавателям подумать о том, как практика аргументации связана с практикой объяснения, стратегиях, основанных на исследованиях и практике, которые могут способствовать развитию разнообразных форм аргументации учащихся, и о том, как возможности аргументации могут быть реализованы более справедливым образом. |
Наверх
Наверх
| Программы | |
|---|---|
Партнерство по математике и науке | Математическое и научное партнерство (MSP) — это конкурсная программа грантов, предназначенная для поощрения высших учебных заведений, местных школьных округов, начальных и средних школ к участию в мероприятиях по профессиональному развитию, которые повышают предметные знания и навыки преподавания математики и естественных наук. учителя. |
Президентские награды за выдающиеся достижения в области преподавания математики и естественных наук | Эта программа награждения открыта для практикующих учителей государственных, частных и приходских школ, имеющих не менее пяти лет опыта преподавания. |
Национальная математическая и научная инициатива | Миссия NMSI состоит в том, чтобы улучшить успеваемость учащихся по важнейшим предметам науки, техники, инженерии и математики (STEM). |
Наверх
соединений: факты (Научный путь: Общественное телевидение Айдахо)
Атомы и элементы: строительные блоки всего
Все, что занимает место в нашем мире, является материей. Наука, изучающая материю, называется химией. Вся материя состоит из крошечных частиц, называемых атомами.Атомы составляют воздух, воду, ваше тело, одежду, пищу, которую вы едите, и стул, на котором вы сидите. Но вы не можете видеть атомы. Они настолько малы, что только в точке в конце этого предложения находятся миллиарды атомов. Существуют различные типы атомов, и они особым образом сочетаются друг с другом, чтобы составить всю материю в мире.
Все атомы состоят из еще более мелких частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны собираются вместе в ядре или центре атома, в то время как электроны вращаются вокруг ядра.
Все во вселенной состоит из элементов. Нам известно о 92 элементах, встречающихся в природе, но учеными было создано еще несколько, всего их 118. Элемент — это чистое вещество, состоящее из атомов одного типа. Например, золото — это элемент, состоящий из атомов золота. Кислород – это элемент, состоящий из атомов кислорода. Периодическая таблица элементов используется для организации элементов по их атомному номеру или количеству протонов в ядре.Например, кислород имеет 8 протонов, поэтому его атомный номер равен 8. Химические символы обозначают каждый элемент. Вы можете узнать гораздо больше об атомах и элементах из периодической таблицы.
Соединения
Когда два или более атома соединяются вместе, мы называем это молекулой. Когда два или более атома различных элементов соединяются вместе, мы называем это соединением. Все соединения являются молекулами, но не все молекулы являются соединениями. Это потому, что молекула может состоять из двух атомов одного и того же типа, например, когда два атома кислорода соединяются вместе, образуя молекулу кислорода. Однако все соединения состоят из двух или более различных типов атомов.
Однако все соединения состоят из двух или более различных типов атомов.
Элементы редко встречаются в чистом виде; соединения встречаются гораздо чаще. Существует чуть более 100 различных видов атомов, но существуют миллионы различных видов веществ, состоящих из разных типов молекул. Вероятно, все, что вы видите вокруг себя, является каким-то соединением. Когда атомы разных видов объединяются, образуя соединение, создается новое вещество. Новые соединения не обладают такими же физическими или химическими свойствами, как исходные элементы.У них своя новая жизнь.
Соединения записываются с помощью формул, показывающих, какие элементы из таблицы Менделеева объединяются. Одним из очень знакомых соединений является вода. Когда два атома водорода (h3) соединяются с одним атомом кислорода (O), образуется соединение h3O, известное нам как вода. Все молекулы воды имеют одну и ту же комбинацию атомов. Вода не водород и не кислород. Нельзя подливать атомы кислорода и водорода в огонь и ожидать, что он потухнет. Но когда они связаны друг с другом как молекулы воды, они ведут себя как вода.Соединение — это совершенно новое вещество со своими свойствами.
Но когда они связаны друг с другом как молекулы воды, они ведут себя как вода.Соединение — это совершенно новое вещество со своими свойствами.
Одни и те же элементы могут образовывать очень разные соединения. Если вы возьмете эти два атома водорода и соедините их с двумя атомами кислорода (вместо одного), вы получите не воду, а h3O2, совсем другое соединение, называемое перекисью водорода, — вы не захотите его пить!
- Есть много других соединений, которые вам уже знакомы:
- Когда один атом натрия (Na) соединяется с одним атомом хлора (Cl), образуется соединение NaCl, известное нам как соль.
- Каждый раз, когда вы выдыхаете, ваше дыхание содержит CO2, соединение одного атома углерода (C) и двух атомов кислорода (O2), которое мы называем двуокисью углерода.
- Иногда более двух элементов составляют соединение. Молекула сахара (глюкозы) представляет собой соединение из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, обозначаемое как C6h22O6.
 Эти конкретные атомы в точном количестве составляют молекулу сахара.
Эти конкретные атомы в точном количестве составляют молекулу сахара. - Когда четыре разных вида атомов (натрий, водород, углерод и кислород) объединяются определенным образом, мы получаем NaHCO3, известный вам как пищевая сода.Если бы эти атомы были объединены по-другому, это не была бы пищевая сода.
Химические связки
Как образуются эти соединения? Что удерживает атомы в молекуле вместе? Ответ заключается в том, что соединения образуются, когда элементы соединяются и удерживаются вместе сильными силами, называемыми химическими связями. В этих связях участвуют электроны, вращающиеся вокруг ядра атома. Электроны располагаются на энергетических уровнях, находящихся на определенных расстояниях от ядра, называемых оболочками.Каждая из этих оболочек может нести определенное количество электронов (например, 2 в первой оболочке, 8 во второй и т. д.). оболочка не заполнена, атомы пытаются соединиться с другими атомами, отдавая или приобретая электроны. Атомы с почти пустой внешней оболочкой захотят отдать электроны, а атомы с почти полной внешней оболочкой захотят получить электроны, чтобы заполнить ее.
Существует два основных типа связей, которые удерживают вместе большинство соединений.Ионные связи образуются, когда один атом отдает или отдает электрон другому, чтобы оба имели полную внешнюю оболочку. При этом атомы соединяются и создают соединение. Ковалентные связи делят электроны между атомами, чтобы заполнить их электронные оболочки. В соединении молекулы удерживаются вместе за счет притяжения между ядром и общими электронами.
Соединения и смеси
Часто вещества могут соединяться, не образуя соединения.Чтобы создать соединение, должна произойти химическая реакция, в ходе которой образуются связи и создается совершенно новое вещество. Без этой химической реакции объединенные вещества могут вместо этого образовывать смесь.
Компоненты смеси сохраняют свои первоначальные свойства и легко разделяются. Например, смесь фруктов в салате можно снова разделить на группы разных видов фруктов. Соль и воду можно соединить в смесь, но вода остается водой, а соль остается солью. Чтобы разделить два компонента, воду можно выпарить, чтобы можно было собрать соль. Песок и воду можно разделить с помощью фильтра. Океан, скалы, кровь и даже воздух, которым мы дышим, представляют собой смеси, а не соединения.
Чтобы разделить два компонента, воду можно выпарить, чтобы можно было собрать соль. Песок и воду можно разделить с помощью фильтра. Океан, скалы, кровь и даже воздух, которым мы дышим, представляют собой смеси, а не соединения.
С другой стороны, компоненты соединения не могут быть разделены физическими средствами. Узнайте больше о соединениях и смесях.
Физические и химические изменения
Физические изменения не разрушают соединения.Физические изменения влияют на размер, форму или состояние вещества, но не на химические свойства. Вы можете изменить состояние материи, но соединение не изменится. Если вы оставите кубик льда на солнце, он растает и превратится в жидкую воду, но в любом состоянии он по-прежнему состоит из молекул воды. Вы можете приложить физическую силу к твердому стеклу и разбить его, но молекулы, из которых состоит стекло, останутся.
Химические изменения в соединениях происходят при создании или разрушении химических связей.Затем меняется молекулярная структура; формируются новые молекулы и создается новое вещество. Часто тепло используется для начала химического превращения, например, при выпечке пирога. Другой пример химической реакции — ржавление металлического мусорного бака. Ржавление происходит из-за того, что железо (Fe) в металле соединяется с кислородом (O2) в воздухе. Химические связи создаются и разрушаются, в конечном итоге образуя оксид железа (Fe2O3), который мы называем ржавчиной.
Часто тепло используется для начала химического превращения, например, при выпечке пирога. Другой пример химической реакции — ржавление металлического мусорного бака. Ржавление происходит из-за того, что железо (Fe) в металле соединяется с кислородом (O2) в воздухе. Химические связи создаются и разрушаются, в конечном итоге образуя оксид железа (Fe2O3), который мы называем ржавчиной.
Разорвать химические связи непросто, но это можно сделать в ходе химических реакций, используя энергию для разрыва связей.Например, электрический ток, проходящий через воду, может вызвать химическое изменение, при котором вода расщепляется на водород и кислород. Когда химик смешивает различные соединения в химической реакции, соединения могут объединяться в одно соединение или превращаться в несколько новых соединений. Некоторыми признаками химической реакции являются изменение температуры, образование газа или изменение цвета.
Наименование соединений
У ученых есть особый способ называть соединения. Есть несколько сложных правил, но давайте сосредоточимся на простых. Для молекул с двумя элементами название соединения состоит из двух слов: название первого элемента и название второго элемента, изменяющее свое окончание на «ide». Например, если вторым элементом в соединении является кислород, он становится «оксидом». Если хлор является вторым элементом, он становится «хлоридом».
Есть несколько сложных правил, но давайте сосредоточимся на простых. Для молекул с двумя элементами название соединения состоит из двух слов: название первого элемента и название второго элемента, изменяющее свое окончание на «ide». Например, если вторым элементом в соединении является кислород, он становится «оксидом». Если хлор является вторым элементом, он становится «хлоридом».
Если один из элементов имеет более одного атома, к началу названия элемента добавляется префикс в зависимости от количества атомов.Если есть два атома, вы добавляете «ди» в начале. Если их три, вы добавляете «tri» в начале. Если их четыре, вы добавляете «тетра».
Соединение одного атома натрия и одного атома хлора называется хлоридом натрия.
(1) натрий и (1) хлор = хлорид натрия (NaCl)
Соединение одного атома магния и одного атома серы (MgS) называется сульфидом магния.
(1) Магний и (1) Сера = сульфид магния (MgS)
Соединение одного атома углерода и двух атомов кислорода называется двуокисью углерода.
(1) Углерод + (2) Кислород = Углекислый газ (CO2)
Соединение одного атома углерода и четырех атомов хлора называется четыреххлористым углеродом. (1) Углерод + (4) Хлор = Четыреххлористый углерод (CCl4)
Немного потренировавшись, вы скоро заговорите на «языке» химических соединений!
21 увлекательное занятие по периодической таблице для студентов-химиков всех возрастов
Периодическая таблица элементов является ключом к пониманию и усвоению химических концепций.Эти упражнения с периодической таблицей веселые и увлекательные, и вы можете использовать многие из них как с младшими, так и со старшими учениками. Выберите несколько, чтобы попробовать в своем собственном классе!
Напоминаем, что WeAreTeachers может собирать долю продаж по ссылкам на этой странице. Спасибо за Вашу поддержку!
1. Начните с якорной диаграммы
Периодическая таблица — гениальная конструкция, но она требует небольшого пояснения. Эти якорные диаграммы объясняют расположение и детали и являются отличным справочным материалом для использования во всех ваших действиях с периодической таблицей.
Эти якорные диаграммы объясняют расположение и детали и являются отличным справочным материалом для использования во всех ваших действиях с периодической таблицей.
Подробнее: Школьный
2. Изучите иллюстрированную таблицу Менделеева
Учителя любят эту таблицу, и не зря. Это оживляет таблицу, помогая студентам-химикам понять, какую роль каждый элемент играет в окружающем нас мире. Вы можете бесплатно распечатать его копии или купить плакаты и наборы открыток. Есть даже интерактивная версия!
Узнайте больше: elements.wlonk.com
3. Раскрась и узнай об элементах
Вы можете использовать эту умную книжку-раскраску для всех видов занятий с периодической таблицей.Попробуйте несколько бесплатных печатных страниц с сайта автора Терезы Бондора здесь. Если они вам нравятся, купите книжку-раскраску «Периодическая таблица элементов» на Amazon.
4. Спойте песенку из таблицы Менделеева
youtube.com/embed/rz4Dd1I_fX0?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Хотя детям не обязательно запоминать периодическую таблицу, такие песни могут помочь, если они захотят попробовать! Нам нравится этот новый современный подход, но и старая классика Тома Лерера 1959 года тоже доставляет массу удовольствия.
5. Соберите модель из коробок для яиц
Любите хорошие поделки из вторсырья? Это деятельность, которую вы ищете! Накопите картонные коробки для яиц и используйте их для создания модели таблицы Менделеева.
Подробнее: Странные несоциализированные школьники
6. Создайте колоду карт элементов
Эти бесплатные распечатанные карточки отлично подходят для повторения элементов, особенно если вы работаете над запоминанием некоторых или всех из них.
Подробнее: Домашнее школьное творчество
7.
 Изготовьте элемент очистителя труб модели .
Изготовьте элемент очистителя труб модели .Получите более глубокое представление о конструкции каждого элемента, создавая модели с помпонами, бусинами и ершиками для труб.
Узнайте больше: Обучайте рядом со мной
8. Найдите элементы, чтобы выиграть игру
Узнайте, где расположен каждый элемент на столе, а также их аббревиатуры в этой простой (и бесплатной) компьютерной игре «укажи и щелкни».
Узнайте больше: Mr. Nussbaum Learning + Fun
9. Отправляйтесь на поиски элементов
Отправьте учащихся на поиск реальных примеров различных элементов.Они будут удивлены тем, как легко их найти.
Узнать больше: Pinay Homeschooler
10. Составьте периодическую таблицу гигантских плиток
Этот классический исследовательский проект объединяется в гигантской периодической таблице. Вы можете использовать доску для плакатов или добавить трехмерный элемент, вместо этого создав плитки на коробках для пиццы.
Подробнее: миссмиклиус
11. Играть в периодическую таблицу Морской бой
Вот еще одна забавная игра, которая поможет детям познакомиться с тем, где на столе находятся различные элементы.Узнайте, как играть по ссылке.
Узнайте больше: Обучайте рядом со мной
12. Превратите элементы в супергероев (или злодеев)
Это такой забавный поворот в обычном проекте по исследованию элементов. Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Подробнее: Morpho Science/Teachers Pay Teachers
13. Загрузите приложение Atomidoodle
Это классное маленькое приложение, доступное как в Apple AppStore, так и в Google Play, предлагает учащимся рисовать пути в лабиринтах.Они используют слияние (сложение) и деление (деление) для создания новых атомов, изучая при этом сотни фактов об элементах.
Подробнее: Атомидудл
14. Сортировать «периодических людей» в таблицу
Это умное задание дает учащимся возможность увидеть, как Менделеев сортировал элементы, чтобы создать свою блестящую периодическую таблицу. Получите бесплатно по ссылке.
Подробнее: Sunrise Science
15. Повесьте таблицу Менделеева на потолок
Источник: Sentinel округа Джексон
Используйте все свободное пространство в классе, превратив потолочные плитки в огромную таблицу Менделеева! Клейкий винил хорошо подходит для этого амбициозного проекта.
16. Решить
Тайна периодической таблицыЧитателям средней школы понравится этот рассказ о разработке периодической таблицы, они узнают о различных ученых, участвовавших в процессе. Купить The Mystery of the Periodic Table на Amazon можно здесь.
17. Знакомство с персонажами Элемента
Каждый элемент имеет свой собственный набор характеристик, которые почти можно назвать его личностью. В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей.Вы можете использовать набор из них для всех видов периодической таблицы.
В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей.Вы можете использовать набор из них для всех видов периодической таблицы.
Подробнее: Элементы — эксперименты в дизайне персонажей
18. Победить квест из таблицы Менделеева
Эскейп-комнаты в моде, и в классе тоже очень весело. Создайте свой собственный набор задач, основанных на химии, или купите эту готовую квест-комнату с таблицей Менделеева на сайте Teachers Pay Teachers.
Узнать больше: Kesler Science
19.Сделать пиксельную графику периодической таблицы
В этой бесплатной интерактивной программе учащиеся отвечают на вопросы об элементах, чтобы разблокировать квадраты периодической таблицы, создав пиксельную картинку. Бонус: пусть дети создают свои собственные пиксельные картинки, используя таблицу!
Подробнее: Преподавание вне теста
20.
 Соберите разноцветные плитки
Соберите разноцветные плиткиЭти красочные детали соединяются друг с другом, образуя интерактивную головоломку, которую можно использовать для множества различных действий с периодической таблицей.Купите набор на Amazon.
21. Соревнуйтесь в таблице Менделеева Бинго
Бинго — это всегда весело, но эта версия также поможет вам выучить различные сокращения элементов. Сделайте свои карты или купите готовый набор по ссылке.
Подробнее: Семейство с питанием от STEAM
Хотите узнать больше о практических занятиях? Попробуйте лучшие научные наборы для детей, выбранные учителями.
Plus, 20 лучших научных досок объявлений и идей декора классных комнат.
Факты о воде
Вот 18 интересных фактов о воде, одном из самых простых и распространенных соединений во Вселенной.
18 интересных фактов о воде
Доктор Дуг Стюарт
1. Вода представляет собой соединение двух наиболее распространенных во Вселенной элементов: водорода и кислорода. (Только гелия больше, чем кислорода во Вселенной, но гелий не образует соединений.)
Вода представляет собой соединение двух наиболее распространенных во Вселенной элементов: водорода и кислорода. (Только гелия больше, чем кислорода во Вселенной, но гелий не образует соединений.)
2. Химическая формула воды H 2 O известна лучше, чем формула любого другого соединения.
3. Скорость света в воде составляет три четверти скорости света в воздухе. Эта разница скоростей заставляет свет преломляться (менять направление), когда он проходит между воздухом и водой. Результатом этого является то, что предметы под водой, рассматриваемые под углом с суши, на самом деле не находятся в точном месте, которое предполагают наши глаза и мозг.
4. Скорость звука в воде в 4,3 раза больше, чем в воздухе при 20 °С. За одну секунду звук проходит:
- 344 метра по сухому воздуху
- 1483 метра по пресной воде
- 1522 метра по морской воде
5.Низкочастотные звуки могут распространяться в воде на огромные расстояния с небольшим уменьшением громкости. Это позволяет китам общаться на огромных расстояниях в океанах.
Это позволяет китам общаться на огромных расстояниях в океанах.
Низкочастотные крики горбатых китов могут при благоприятных условиях распространяться в океанах на тысячи миль.
6. Твердое состояние воды менее плотное, чем жидкое. В результате лед плавает на воде. Это крайне необычно — противоположное справедливо почти для всех других веществ. Если бы лед тонул в воде, наш мир был бы совершенно другим местом.Лед будет накапливаться на дне моря, что будет иметь огромные последствия для климата и жизни.
Айсберги, плавающие на воде, возможны только из-за необычного поведения воды.
7. Необычно то, что повышение давления на лед снижает его температуру плавления. Когда фигурист движется по льду, высокое давление лезвий коньков плавит тонкий слой льда прямо под ними. Этот тонкий слой воды на льду имеет очень низкое трение, в результате чего фигуристу очень легко двигаться — либо изящно в случае опытных фигуристов, либо часто некрасиво падая для неопытных фигуристов.
8. Вода имеет рН 7. Она нейтральна по кислотно-щелочной шкале.
Вода нейтральна по шкале pH.
9. Вода имеет очень низкую молекулярную массу всего 18 и состоит из двух атомов водорода и одного кислорода (1 + 1 + 16 = 18). Исходя из этого, кислород должен быть газом комнатной температуры. Если бы это было так, жизнь была бы невозможна.
Однако электрический заряд внутри молекулы воды распределен неравномерно. Хотя в целом каждая молекула воды электрически нейтральна, атом кислорода имеет слегка отрицательный заряд, а атомы водорода — слегка положительный.Это приводит к образованию водородных связей между молекулами воды, резко повышая температуру плавления и кипения воды до их хорошо известных значений.
Водородные связи между отдельными молекулами сильно влияют на свойства воды.
10. Полярные связи воды позволяют ей растворять многие вещества, что делает ее идеальным растворителем для химии жизни.
11. Вода покрывает 71 процент поверхности нашей планеты, поэтому ее цвет при взгляде из космоса — синий.
Наша голубая планета с пересечением Луны.
12. Вода действует как растворитель для газообразного кислорода. Если бы не это, не было бы и рыбы. Чем холоднее вода, тем больше кислорода она может удерживать.
13. Вода жизненно необходима для всех известных форм жизни. У людей более половины массы тела — это просто вода. Взрослым самцам требуется около 3 литров воды в день, а самкам около 2 литров воды. Это не обязательно должно происходить из чистой воды: это может происходить из других напитков и, конечно же, большая часть пищи, которую мы едим, состоит в основном из воды.
Вода является основным компонентом большинства частей нашего тела.
14. Хотя чистая вода выглядит прозрачной, на самом деле она слегка голубая.
15. Вода обладает высоким поверхностным натяжением, что позволяет плавать предметам, плотность которых должна заставить их тонуть.
Сталь плотнее воды и обычно тонет. Если сталь достаточно легкая, как, например, скрепка здесь, поверхностное натяжение воды удерживает сталь снаружи воды.
16. Помимо высокого поверхностного натяжения, вода довольно липкая, что позволяет ее каплям собираться в самых разных местах.
Поверхностное натяжение и липкость воды позволяют каплям росы образовываться и собираться, например, на этой паутине.
17. Совершенно чистая вода — очень плохой проводник электричества. Однако ни одна вода, с которой мы сталкиваемся в повседневной жизни, не является абсолютно чистой. Бытовая вода, содержащая растворенные вещества, является достаточно хорошим проводником электричества.
18. Вода обладает большой теплоёмкостью. Чтобы поднять температуру килограмма воды на 1 градус, требуется гораздо больше энергии, чем килограмм горной породы.Вы, наверное, замечали, что когда солнце палит на скалу, она становится намного горячее, чем вода под тем же солнцем. Вода также выделяет гораздо больше энергии при охлаждении, чем горная порода. Вот почему сезонные колебания температуры в прибрежных районах и на островах обычно намного меньше, чем в центрах континентов.
Медь — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: медь
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец акции)
Крис Смит
Привет, на этой неделе монеты, проводимость и медь. Чтобы рассказать историю об элементе, который перенес нас из каменного века в век информации, вот Стив Майлон.
Стив Майлон
Бедная медь, до недавнего времени она, казалось, уступала в прямом и переносном смысле своим собратьям из переходных металлов, Серебру и Золоту. Я предполагаю, что это комбинированный результат, который история имеет в изобилии.Почти никогда не бывает так, чтобы популярные элементы были такими из-за их полезности и интересного химического состава. Но для Gold и Silver это все так поверхностно. Они более популярны, потому что они красивее. Моя жена, например, не химик, не мечтает носить медное обручальное кольцо. Возможно, это как-то связано с тем фактом, что оксид меди имеет раздражающую привычку окрашивать кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы узнать ее немного; может быть, тогда она, вероятно, повернется спиной к другим и будет носить его с гордостью.
Но для Gold и Silver это все так поверхностно. Они более популярны, потому что они красивее. Моя жена, например, не химик, не мечтает носить медное обручальное кольцо. Возможно, это как-то связано с тем фактом, что оксид меди имеет раздражающую привычку окрашивать кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы узнать ее немного; может быть, тогда она, вероятно, повернется спиной к другим и будет носить его с гордостью.
Некоторые сообщают, что медь — это первый металл, добытый и изготовленный людьми. Так это или нет, но есть свидетельства того, что цивилизации использовали медь еще 10 000 лет назад. Чтобы культуры перешли от каменного века к бронзовому, им нужна была медь. Бронза состоит из 2 частей меди и 1 части олова, а не серебра или золота. Важность меди для цивилизации никогда не ослабевала, и даже сейчас из-за ее превосходной проводимости медь пользуется большим спросом во всем мире, поскольку быстро развивающиеся страны, такие как Китай и Индия, создают инфраструктуру, необходимую для подачи электричества в дома своих граждан. Например, за последние пять лет цена на медь увеличилась более чем в четыре раза. Возможно, самой большой пощечиной этому важному металлу является его использование в монетах во многих странах мира. Оранжево-коричневые монеты, как правило, имеют низкий номинал, в то время как блестящие, более серебряные монеты занимают место вверху. Даже в 5-центовой монете США никель выглядит блестящим и серебристым, но на самом деле содержит 75% меди и только 25% никеля. Но мы даже не называем это медью.
Например, за последние пять лет цена на медь увеличилась более чем в четыре раза. Возможно, самой большой пощечиной этому важному металлу является его использование в монетах во многих странах мира. Оранжево-коричневые монеты, как правило, имеют низкий номинал, в то время как блестящие, более серебряные монеты занимают место вверху. Даже в 5-центовой монете США никель выглядит блестящим и серебристым, но на самом деле содержит 75% меди и только 25% никеля. Но мы даже не называем это медью.
Конечно, я мог бы продолжать и продолжать выявлять много интересных фактов и фактов о меди и о том, почему другие должны относиться к ней с подозрением. Они легко могли бы, потому что это также отличный проводник тепла, но я нахожу этот металл таким интересным и по многим другим причинам. Медь является одним из немногих металлов-индикаторов, необходимых для всех видов. По большей части биологическая потребность в меди довольно низка, так как только несколько ферментов, таких как цитохромоксидаза и супероксиддисмутаза, требуют меди в своих активных центрах. Обычно они основаны на окислительно-восстановительном цикле и играют важную роль в дыхании. Для людей потребность в меди также довольно низкая, всего 2 мг меди в день для взрослых. Тем не менее, слишком мало меди в вашем рационе может привести к высокому кровяному давлению и повышению уровня холестерина. Интересно, что для меди разрыв, разделяющий необходимое количество и токсичное количество, довольно мал. Он может быть наименьшим для всех необходимых микроэлементов. Вероятно, поэтому он широко используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнять свою работу.
Обычно они основаны на окислительно-восстановительном цикле и играют важную роль в дыхании. Для людей потребность в меди также довольно низкая, всего 2 мг меди в день для взрослых. Тем не менее, слишком мало меди в вашем рационе может привести к высокому кровяному давлению и повышению уровня холестерина. Интересно, что для меди разрыв, разделяющий необходимое количество и токсичное количество, довольно мал. Он может быть наименьшим для всех необходимых микроэлементов. Вероятно, поэтому он широко используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнять свою работу.
По моему мнению, вы вряд ли найдете в таблице Менделеева металл, обладающий такой же универсальностью, как медь, и при этом не пользующийся заслуженным уважением среди себе подобных. Хотя он значительно более распространен, чем золото и серебро, его значение в истории не имеет себе равных, а его полезность на макроуровне сопоставима только с его полезностью на микроуровне. Никакой другой металл не может конкурировать.
Никакой другой металл не может конкурировать.
Итак, я попытаюсь объяснить это своей жене, когда подарю ей пару медных сережек или красивое медное ожерелье в эти праздничные дни.Я предполагаю, что она вздернет нос, потому что подумает, что пенни сделаны из этого материала, хотя в наши дни это совсем не так.
Крис Смит
Мужчина, женатый на меди, это Стив Майлон. В следующий раз мы будем углубляться в открытие элемента с очень огненным темпераментом.
Питер Уотерс
Его младший двоюродный брат Эдмунд Дэви в то время помогал Хамфри, и он рассказывает, как, когда Хамфри впервые увидел, как крошечные шарики калия прорываются сквозь корку поташа и загораются, он не мог сдержать радости.Дэви имел полное право быть в восторге от этого удивительного нового металла. Он выглядит точно так же, как другие яркие блестящие металлы, но его плотность меньше, чем у воды. Это означало, что металл будет плавать на воде. По крайней мере, сойдет, если он не взорвется, как только соприкоснется с водой..PNG)

 Таким свойством наделена сверхчистая вода без примесей (именно вокруг них образуется кристаллизация). Даже при температуре –40 °C она не превращается в лед и становится сверхохлажденной.
Таким свойством наделена сверхчистая вода без примесей (именно вокруг них образуется кристаллизация). Даже при температуре –40 °C она не превращается в лед и становится сверхохлажденной. Поскольку она превосходный природный растворитель, то растворяет и ядовитые вещества, поэтому становится переносчиком болезнетворных бактерий. Так, 85% болезней в мире передается именно через воду. Из-за плохой воды в мире каждые 8 секунд умирает один человек.
Поскольку она превосходный природный растворитель, то растворяет и ядовитые вещества, поэтому становится переносчиком болезнетворных бактерий. Так, 85% болезней в мире передается именно через воду. Из-за плохой воды в мире каждые 8 секунд умирает один человек.
 Ядро чрезвычайно плотное и содержит всю массу атома. Поскольку ядро так трудно расщепить, атомы могут существовать вечно.
Ядро чрезвычайно плотное и содержит всю массу атома. Поскольку ядро так трудно расщепить, атомы могут существовать вечно.


 Программы NMSI трансформируют преподавание, трансформируют школы и трансформируют образование в Соединенных Штатах.
Программы NMSI трансформируют преподавание, трансформируют школы и трансформируют образование в Соединенных Штатах. Эти конкретные атомы в точном количестве составляют молекулу сахара.
Эти конкретные атомы в точном количестве составляют молекулу сахара.