Химия: 10 интересных фактов — Новости химии — Новости науки
Комментариев: 0Эта коллекция состоит из 10 забавных и интересных фактов о химии.
Факт 1: Химия изучает материи и энергии и взаимодействие между ними. Это физическая наука, она очень тесно связана с физикой, которая практически всегда имеет то же самое определение.
Факт 2: Химия своими корнями уходит к древнему изучению алхимии. Химия и алхимия сейчас являются разными науками, хотя алхимия по-прежнему практикуется.
Факт 3: Все вещества состоят из химических элементов, которые отличаются друг от друга количеством протонов, которыми они обладают.
Факт 4: Химические элементы упорядочены в порядке возрастания атомного номера в таблице Менделеева. Первый элемент в таблице Менделеева является водородом.
Факт 5: Каждый элемент в таблице Менделеева имеет одно или два буквенного обозначения. Одна единственная буква в английском алфавите не используется в таблице Менделеева, это буква J. Буква Q используется только для элемента под номером 114 (Флеровий), который имеет символ Uuq. Когда элемент под номером 114 будет официально обнаружен, ему дадут новое имя.
Факт 6: При комнатной температуре могут существовать только два элемента. Это бром и ртуть.
Факт 7: Название ИЮПАК для воды, h3O, является дигидрофосфатом окиси.
Факт 8: Большинство элементов являются металлами и большинство из них имеют серебристый или серый цвет.
Факт 9: Первооткрыватель элемента может дать ему свое имя! Существуют элементы с именами народа, мест, городов, стран.
Факт 10: Вы можете считать золото редкостью, но в земной коре достаточно золота, чтобы покрыть поверхность земли планеты по колено.
Три факта о химии поверхностей
Что общего между автомобилями, космическими скафандрами и имплантатами? Три факта о химии поверхностей
Мы можем этого не замечать, однако химия поверхностей, в том числе поверхностей имплантатов, влияет на нашу повседневную жизнь.
3 факта, которые необходимо знать о химическом составе поверхности.
О чем мы вспоминает в первую очередь, когда говорим о поверхности имплантатов?
Шероховатость?
Топография?
Дизайн тела имплантата и резьбы?
Когда речь идет о поверхности имплантатов, в течение многих лет всех интересовал вопрос ее шероховатости. Ведь именно она является ключевым фактором в скорости наступления остеоинтеграции.[i]
Однако пора исследовать этот вопрос более глубоко. Забыть на время о геометрии и топографии и вспомнить о химии. Если вы интересуетесь наукой и технологиями, то наверняка знаете, что химия — это удивительная область знаний, влияющая на нашу повседневную жизнь. И это также относится к химическим свойствам имплантатов, которые доктора используют для успешного лечения пациентов и, в конечном итоге, улучшения их качества жизни.
Вот три интересных факта, которые необходимо знать о химии поверхностей как в стоматологии, так и в других областях.
1. Химический состав поверхности определяет то, в какие реакции вступает материал — и это также касается имплантатов.
Химия поверхности — это ее химический состав. Поверхность материала образует «пограничный отряд» из атомов, которые сталкиваются с атомами другого материала. От химического состава поверхности зависит, какие химические реакции будут происходить на стыке с молекулами других веществ (твердых, жидких или газообразных).[ii]
В случае с имплантатами химический состав поверхности определяет реакции, которые будут происходить между имплантатом и клетками/белками.
Будет ли поверхность поглощать, впитывать или выделять другие вещества?
Будет ли на поверхности гидрофильный или гидрофобный слой?
Произойдет ли кристаллизация или катализация? Образует ли поверхность имплантата и абатмента химические связи с белками? Это и определяется химическим составом поверхности.
Химия поверхностей — крайне интересная область. Однако самое удивительное это то, как эти знания применяются на практике, когда с помощью технологий удается контролировать химический состав поверхности и извлекать преимущества из химических реакций, а также то, каким образом это способствует достижению высоких клинических результатов.
2. Химия поверхностей играет огромную роль во многих сферах — от повседневной жизни до космических полетов и стоматологического лечения.
Давайте рассмотрим химию поверхности в контексте. Это не только узкое направление в имплантологии — химический состав поверхности имеет значение в применении различных технологий, в промышленности и производстве. Вот несколько примеров:
Teflon™ — тефлон (политетрафторэтилен) — имеет цепочку связей между атомами углерода и фтора, которые сильны настолько, что другим атомам сложно соединиться с поверхностью.[iii] Наиболее известен как антипригарная поверхность для посуды. Однако настоящую славу тефлон получил после использования в качестве защитного материала космических скафандров для миссии «Аполлон». Также существуют медицинские изделия и хирургические инструменты с тефлоновым защитным покрытием.
Каталитические конвертеры — поверхность каталитического конвертера в автомобиле покрыта катализаторами, которые при контакте с выхлопными газами вызывают окисление угарного газа и углеводородов, а также снижают концентрацию оксида азота. [iv]
Технологии на основе полупроводников — микрочипы в телефоне, компьютере и практически в любом другом цифровом устройстве содержат миллионы транзисторов, которые созданы с помощью сложных химических процессов, включая химическое парофазное осаждение, кристаллизацию и травление.
Этот список можно продолжать и дальше. Однако почему это так важно для стоматологических имплантатов и абатментов?
3. Наступление интеграции тканей после установки имплантата зависит от химического состава поверхности.
По сути, химический состав поверхности имплантата запускает реакцию в клетках и белках.
Разные функциональные группы молекул реагируют по-разному, стимулируя или угнетая интеграцию тканей. Когда требуется, чтобы поверхность медицинских изделий предотвращала адгезию белков, она может содержать гидрофобный слой. Однако в случае установки имплантатов необходима такая химическая реакция, в результате которой образуются точки прикрепления клеток кости и мягких тканей.
Одним из способов изменения химического состава поверхности имплантата является анодирование. Если вы не знакомы с анодированием, то это процесс, в ходе которого титановый имплантат погружают в раствор электролита и затем пропускают через него электрический ток. В результате происходит утолщение слоя оксида титана и изменение текстуры поверхности. Если в раствор электролита добавить определенные молекулы, они присоединятся к оксиду и изменят химический состав поверхности. Это и определяет химические реакции, которые будут происходить при контакте поверхности с тканями организма.1 Было обнаружено, что определенные химические элементы способствуют положительному биологическому ответу тканей на поверхность металла.[v] [vi] [vii]
Так, очень важным оказалось наличие на поверхности гидроксильных групп (ОН), которые, как было доказано, способствуют остеоинтеграции и формированию кости.[viii][ix][x] Чем больше гидроксильных групп, тем больше поверхность имеет точек прикрепления фибриногена, участвующего в образовании сгустков крови. Исследования показывают, что анодированные поверхности имеют больше гидроксильных групп, чем имплантаты, прошедшие пескоструйную обработку и кислотное травление.[xi]
На интеграцию тканей влияет еще одно химическое свойство — гидрофильность поверхности.[xii] [xiii] Способность клеток прикрепляться к поверхности определяется степенью адсорбции белка. Многие исследования показали, что к гидрофильным поверхностям белки прикрепляются лучше, чем к гидрофобным аналогам.
Взгляд в будущее
Когда речь шла о поверхности имплантатов, в течение десятилетий самым обсуждаемым вопросом была ее текстура. Однако с развитием науки о химии поверхностей в целом и расширением областей ее практического применения технологии изменения поверхности на молекулярном уровне стали доступны и для дентальных имплантатов. И если мы говорим об ускорении и улучшении качества интеграции кости и мягких тканей, то также необходимо уделять внимание и химическому составу поверхности.
Однако с развитием науки о химии поверхностей в целом и расширением областей ее практического применения технологии изменения поверхности на молекулярном уровне стали доступны и для дентальных имплантатов. И если мы говорим об ускорении и улучшении качества интеграции кости и мягких тканей, то также необходимо уделять внимание и химическому составу поверхности.
[i] Bauer S, Schmuki A, von der Mark K, Park J,; Engineering biocompatible implant surfaces Part I: Materials and surfaces, Progress in Materials Science 58 (2013) 261–326
[ii] Gabor A.S, Y. L. (2011, January 18). Impact of surface chemistry. PNAS, 108(3), pp. 917-924
[iii] Tzoraki O, Lasithiotakis M Environmental Risks Associated with Waste Electrical and Electronic Equipment Recycling Plants Reference Module in Earth Systems and Environmental Sciences, 2018 https://doi.org/10.1016/B978-0-12-409548-9.10980-7
[iv] Taylor K.C. (1984) Automobile Catalytic Converters. In: Anderson J.R., Boudart M. (eds) Catalysis. Catalysis (Science and Technology), vol 5. Springer, Berlin, Heidelberg doi: https://doi.org/10.1007/978-3-642-93247-2_2
[v] Zhang BG, Myers DE, Wallace GG, Brandt M, Choong PF. Bioactive coatings for orthopaedic implants-recent trends in development of implant coatings. Int J Mol Sci 2014; 15: 11878-11921
[vi] Park J-W, Kim Y-J, Jang J-H, Kwon T-G, Bae Y-C, Suh J-Y. Effects of phosphoric acid treatment of titanium surfaces on surface properties, osteoblast response and removal of torque forces. Acta Biomaterialia 2010; 6: 1661-1670
[vii] Park J-W, Kim Y-J, Jang J-H. Enhanced osteoblast response to hydrophilic strontium and/or phosphate ions-incorporated titanium oxide surfaces. Clinical Oral Implants Research 2010; 21: 398-408
[viii] Fujibayashi S, Neo M, Kim HM, Kokubo T, Nakamura T. Osteoinduction of porous bioactive titanium metal. Biomaterials 2004; 25: 443-450
[ix] Lai HC, Zhuang LF, Zhang ZY, Wieland M, Liu X. Bone apposition around two different sandblasted, large-grit and acid-etched implant surfaces at sites with coronal circumferential defects: an experimental study in dogs. Clin Oral Implants Res 2009; 20: 247-253
Clin Oral Implants Res 2009; 20: 247-253
[x] Zhao G, Schwartz Z, Wieland M, Rupp F, Geis-Gerstorfer J, Cochran DL, Boyan BD. High surface energy enhances cell response to titanium substrate microstructure. J Biomed Mater Res A 2005; 74: 49-58
[xi] Kang BS, Sul YT, Oh SJ, Lee HJ, Albrektsson T. XPS, AES and SEM analysis of recent dental implants. Acta Biomater 2009; 5: 2222-2229
[xii] Smeets R, Stadlinger B, Schwarz F, Beck-Broichsitter B, Jung O, Precht C, Kloss F,; Gröbe A, Heiland M, Ebker T, Impact of Dental Implant Surface Modifications on Osseointegration, BioMed Research International, vol. 2016, Article ID 6285620, 16 pages, 2016. https://doi.org/10.1155/2016/6285620
[xiii] Rupp F, Liang L, Geis-Gerstorfer J, Scheideler L, Hüttig F Surface characteristics of dental implants: A review. Dent Mater. 2018 Jan;34(1):40-57
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
«Нам особенно нужны хорошо образованные люди, близко знающие русскую природу, всю нашу действительность, для того, чтобы мы могли сделать самостоятельные, а не подражательные шаги в деле развития своей страны»
Генеральной ассамблеей ООН 2019 год объявлен Международным годом периодической таблицы химических элементов в честь периодического закона, открытого известным русским учёным Дмитрием Менделеевым в 1869 году.
Напомним, что фундаментальный закон природы, сформулированный великим химиком, через два года совершенствования Менделеевым собственного выражения (1871 г.) имел следующее определение: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
2019 стал годом празднования 150-летнего юбилея периодического закона Д.И. Менделеева. Как верно заметила министр образования и науки России Ольга Васильева в своём интервью РИА Новости: «Традиции отечественной химической школы не иссякают и сегодня. При участии наших учёных происходят открытия новых химических элементов, а наши школьники регулярно достигают высоких результатов на международных соревнованиях».
При участии наших учёных происходят открытия новых химических элементов, а наши школьники регулярно достигают высоких результатов на международных соревнованиях».
«В лабиринте известных фактов легко потеряться без плана»
Значительные открытия Дмитрия Ивановича Менделеева, повлиявшие на развитие химической науки по всему миру, навсегда внесли имя русского учёного в список величайших учёных планеты. Но что мы знаем о гениальном химике как о личности? Какой человек он был? Что ещё помнят люди об известном Менделееве кроме его огромного научного вклада?
Происхождение и семья Д.И. Менделеева
Дмитрий Менделеев родился зимой 1834 года в многодетной семье директора Тобольской гимназии и училищ Тобольского округа. В семье он был самым младшим, семнадцатым. Восемь детей из семнадцати умерли настолько маленькими, что трём из них родители даже не успели дать имена.
Склонность к образованию и науке Менделеев получил от своих родных. Дед Павел Максимович Соколов был священником, отец Иван Павлович Менделеев окончил филологическое отделение Главного педагогического института (сейчас СПбГУ- Санкт-Петербургский государственный университет«), а мать Мария Дмитриевна Менделеева (Корнильева), хоть и не имевшая образования, самостоятельно изучила гимназический курс вместе со своими братьями.
После кончины отца, когда юному Дмитрию было всего тринадцать лет, тяготы содержания многодетной семьи пали на плечи матери. Будучи женщиной смелой и энергичной, она не только много работала, чтобы поставить детей на ноги, но и сумела бросить все дела и переехать в другое место. Первый переезд был связан со смертью кормильца — семья переехала в село Аремзянское, где Мария Дмитриевна управляла стекольной фабрикой.
Другой переезд был необходим для того, чтобы позволить талантливому Дмитрию продолжать свою учёбу в университете. Мать с сыном и младшей дочерью покидают родную Сибирь и переезжают в Москву. Спустя два года после приезда, уже после поступления Менделеева в Главный педагогический институт в Петербурге, Мария Дмитриевна умирает.
Мать с сыном и младшей дочерью покидают родную Сибирь и переезжают в Москву. Спустя два года после приезда, уже после поступления Менделеева в Главный педагогический институт в Петербурге, Мария Дмитриевна умирает.
Интересным представляется факт появления фамилии в семье Менделеевых. По традициям духовенства дед Павел Максимович Соколов передал свою фамилию только одному из сыновей, остальные же получили сторонние фамилии. Так, один из сыновей обрёл фамилию Тихомандрицкий (в честь села, где жила семья), другой — Покровский (в честь прихода, в котором служил священник), а третий сын — Иван — получил фамилию соседских помещиков. Изначально «Менделеев» даже не была фамилией в полном смысле этого слова, а скорее прозвищем. По словам самого же Дмитрия Ивановича фамилия была «…дана отцу, когда он что-то выменял, как соседний помещик Менделеев менял лошадей».
Сам Дмитрий Иванович Менделеев был женат дважды. От двух браков у Менделеева было семеро детей, однако в начале двадцать первого века умер последний потомок рода Менделеевых — внук Александр.
Школа и институт
«Вся гордость учителя в учениках, в росте посеянных им семян»
Многие великие люди, поразившие мир своими открытиями, в детстве не проявляли интерес к наукам. Не стал исключением и Дмитрий Менделеев. Особенно тяжело давались ему латынь и Закон Божий. Да и в студенчестве Дмитрий не хватал звёзд с неба, более того, остались воспоминания, что юноша однажды даже оказался в списке остающихся на второй год обучения из-за плохих отметок по некоторым дисциплинам. Хорошо давалась Менделееву математика, а с течением времени проснулась тяга и к другим предметам. Постепенно молодой человек настолько «втянулся» в учёбу, что по окончании института даже получил золотую медаль.
Любопытно, что позже Менделеев и сам был преподавателем. Около тридцати лет Дмитрий Иванович работал в Императорском Санкт-Петербургском университете. Однако сложный характер учёного послужил причиной его ухода с должности педагога в 1890 году.
Однако сложный характер учёного послужил причиной его ухода с должности педагога в 1890 году.
Химия в тестах, задачах, упражнениях. 8 кл. ВЕРТИКАЛЬ
Пособие содержит разнообразные задания (тесты, задания со свободно конструируемым ответом, расчётные задачи) двух уровней сложности, в том числе в формате ГИА и ЕГЭ. Рассмотрены подходы к решению заданий различных типов. В конце каждого раздела приведены проверочные работы по теме, состоящие из двух частей — обязательной и дополнительной (повышенной сложности). Ко всем заданиям даны ответы.
КупитьД.И. Менделеев и «изобретательские мифы»
«Все дается только труду. Все — труду людскому, таков лозунг истории»
Как часто бывает с известными людьми, личность Д.И. Менделеева была окутана большим количеством придуманных историй и легенд.
Один из известных мифов гласит о том, что именно великий химик стал изобретателем водки. Распространению этого заблуждения послужил тот факт, что в 1865 году Менделеев защитил диссертацию «Рассуждение о соединении воды и спирта». В труде рассматривались свойства смесей воды и спирта, растворов, но никак не пропорции изготовления спиртных напитков. Существование водки как напитка было зафиксировано несколькими столетиями до рождения русского учёного.
Другое, пожалуй, ещё более распространённое заблуждение о свершениях Менделеева гласит о том, что известная периодическая система химических элементов пришла к учёному во сне. Русский химик трудился над созданием известной таблицы более двадцати лет, поэтому миф о том, что система явилась к нему во сне внезапно, без предшествующей работы, была даже оскорбительна для Менделеева. Только непрестанный труд послужил появлению периодической системы. Идея же связи между химическими свойствами и массой пришла к учёному, когда он планировал отправиться в командировку. Пришедшая мысль освежила размышления химика и подала новые пути к открытиям настолько, что Менделеев отложил свою поездку и погрузился в науку с головой.
Увлечения великого химика Менделеева
«Сам удивляюсь — чего только я не делывал в своей научной жизни. И сделано, думаю, неплохо»
На сегодняшний день, пожалуй, самым интересным и неизвестным фактом из жизни Д.И. Менделеева стало необычное увлечение известного химика. Работая с растворами и создавая новые «рецепты», Менделеев изобрел особый вид клея. Его клей был удивительно прочным и качественным, химик даже не доверил никому рецептуру своего «клеевого изобретения». Однако именно это новшество позволило учёному с наслаждением погрузиться в новое хобби — изготовление чемоданов, переплетение книг и клеение рамок для картин. Причём это увлечение достигло такого мастерства, что в Москве и Санкт-Петербурге Менделеев слыл выдающимся профессионалом, а купить чемодан у великого химика было делом особым и значительным. Престижу способствовала не только известность учёного, но и потрясающие качество и долговечность изделий.
Нобелевская премия: быть или не быть
«Капиталом является только та часть богатства, которая обращена на промышленность и производство, но не на спекуляцию и перепродажу»
Печальным фактом научной жизни Д.И. Менделеева стало отсутствие Нобелевской премии. Потрясающий вклад в науку — и полный провал по наградам. Кандидатуру великого химика поддерживали иностранцы, Дмитрий Иванович был трижды номинирован на известную премию. Однако члены императорской академии наук не поддерживали русского учёного на голосовании. Биографы Менделеева, пристально рассматривающие жизнь химика, полагают, что виной такой «непризнанности» стали многочисленные интриги и сложный характер учёного.
Полёты в небо и шпионские тайны
«Границ научному познанию и предсказанию предвидеть невозможно»
Из записей доподлинно известно, что великий химик в течение многих лет разрабатывал конструкцию летательного аппарата. В 1875 году им был разработан проект стратостата. Также он был автором изобретения управляемого аэростата с двигателями. Менделеева захватывали не только изобретения, но и сами полёты — он летал на аэростатах неоднократно. Так, первый полёт был совершён химиком в 1878 году, следующий же случился аж через девять лет.
В 1875 году им был разработан проект стратостата. Также он был автором изобретения управляемого аэростата с двигателями. Менделеева захватывали не только изобретения, но и сами полёты — он летал на аэростатах неоднократно. Так, первый полёт был совершён химиком в 1878 году, следующий же случился аж через девять лет.
Особо стоит отметить полёт Менделеева на воздушном шаре «Русский» в одиночестве. Полёт на высоте более трёх тысяч метров длился около трёх часов. За это время Менделеев смог понаблюдать за полным солнечным затмением и измерить давление и температуру.
«Какой я химик, я политэконом. Что там „Основы химии“, вот „Толковый тариф“ — это другое дело»
Малоизвестным фактом является и то, что Д.И. Менделеев однажды стал промышленным шпионом. В 1890 году правительство обратилось к знаменитому химику за помощью — «послужить научной постановке русского порохового дела», ведь в других странах существовал тайный рецепт бездымного пороха. Естественно, можно было и легально приобрести этот порох, однако цена его была слишком высока. Менделеев, как истовый патриот, согласился выведать секрет бездымного пороха.
Для того чтобы понять тайный состав пороха, химик воспользовался открытой информацией. С помощью данных отчётов железных дорог различных государств (Германия, Франция и Британия) Менделеев смог воссоздать нужную рецептуру и изготовить нужный порох для своего Отечества.
Что ещё почитать?
Вклад Д.И. Менделеева в нефтяную промышленность
«Сжигать нефть, все равно что топить печку ассигнациями»
Особым вкладом Д.И. Менделеева была его теория неорганического происхождения нефти. Также учёным была разработана система её дробной перегонки. Именно Менделеев первым доказал, что нефть не нужно сжигать в топках.
Благодаря открытиям и работам Д.И.Менделеева владельцы-нефтяники стали использовать цистерны при перевозке нефти (до этого пользовались бурдюками). По его же рекомендации промышленники старались строить нефтяные заводы по переработке недалеко от того же места, где и потреблялся нефтепродукт.
По его же рекомендации промышленники старались строить нефтяные заводы по переработке недалеко от того же места, где и потреблялся нефтепродукт.
Менделеев и менделевий
«Границ научному познанию и предсказанию предвидеть невозможно»
Если мы говорим о периодической таблице Менделеева. то стоит и упомянуть об особом её элементе — менделевии (Md). Этот химический элемент был искусственно синтезирован в 1955 году и был назван в честь создателя периодической системы элементов. Менделевий находится в таблице под номером 101.
Стоит упомянуть, что при создании своей системы Менделеев оставил пустыми некоторые клеточки таблицы. и предвосхитил открытие таких элементов, как «экаалюминий» (галлий), «экабор» (скандий), «экасилиций» (германий), «двителлур» (полоний), «экаиод» (астат), «экамарганц» (технеций), «двимарганц» (рений) и «экацезий» (франций). Химик вычислил их атомные массы и указал основные свойства, однако сами элементы были открыты позднее.
Учёный-патриот
«Наука есть достояние общее, а потому справедливость требует не тому отдать наибольшую научную славу, кто первый высказал известную истину, а тому, кто сумел убедить в ней других, показал её достоверность и сделал её применимой в науке»
Д.И. Менделеев был не только учёным-химиком, но и настоящим патриотом. В своём письме С.Ю. Витте (русский государственный деятель, министр путей сообщения, министр финансов), впрочем, так и не отправленном, Дмитрий Иванович писал: «Плоды моих трудов — прежде всего в научной известности, составляющей гордость — не одну мою личную, но и общую русскую… Лучшее время жизни и её главную силу взяло преподавательство… Из тысяч моих учеников много теперь повсюду видных деятелей, профессоров, администраторов, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность… Третья служба моя Родине наименее видна, хотя заботила меня с юных лет по сих пор. Это служба по мере сил и возможности на пользу роста русской промышленности».
Это служба по мере сил и возможности на пользу роста русской промышленности».
Яркие химические реакции. Интересные факты о химии
Химия — это предмет, который известен всем школьникам. Отношение к нему разное: одним нравится наблюдать за тем, как ведут себя реагенты во время разнообразных опытов на уроке, а у других, наоборот, химия вызывает только скуку. Однако не всем известны интересные факты об этой дисциплине. Рассмотрим некоторые из них.
Танцующий кальмар
Химия — это предмет, который находит практическое применение в самых разных областях жизни. Один из интересных фактов о химии связан с японским блюдом под названием «танцующий кальмар». Его изюминка состоит в следующем: недавно пойманного кальмара подают на стол гостю, незадолго до этого полив его соевым соусом. Кальмар начинает шевелить щупальцами, будто танцуя. Этот эффект связан с тем, что в щупальцах кальмара происходит химическая реакция, заставляющая двигаться мышцы.
Скатол
Еще один интересный факт о химии связан с особым веществом под названием скатол. Это органическое соединение, которое придает фекалиям характерный запах. Его бесцветные кристаллы можно найти в различных эфирных маслах, смолах, они также образуются при разложении белка. В небольших дозах это вещество обладает приятным цветочным ароматом. Производители нередко добавляют его в состав духов, сигарет, а также разнообразных пищевых эссенций. Скатол содержится даже в пище.
Яд в алкоголе
А следующий интересный факт о химии послужит предостережением для тех, кто склонен к употреблению спиртных напитков. В их составе может присутствовать очень опасное вещество, которое по вкусу и запаху практически не отличимо от этилового спирта. Это метиловый спирт. Его небольшое количество может привести к слепоте. Доза величиной в 30 мл может спровоцировать остановку сердца. При отравлении метиловым спиртом противоядием к нему является этиловый спирт. Это объясняется тем фактом, что процессы связывания и того, и другого спирта непосредственно зависят от фермента алкогольдегидрогеназы. Данное вещество быстрее реагирует с этанолом. В результате реакции этанол исчерпывается, а большая часть метанола остается нерасщепленной, вследствие чего меньшее количество яда оказывается в крови.
Данное вещество быстрее реагирует с этанолом. В результате реакции этанол исчерпывается, а большая часть метанола остается нерасщепленной, вследствие чего меньшее количество яда оказывается в крови.
Канарейки-спасатели
Немало интересных фактов о химии связано и с миром животных. К примеру, среди шахтеров широко известен факт: канарейки проявляют высокую чувствительность к запаху газа метана. Эта особенность в прошлом всегда использовалась работниками шахт, которые всегда брали с собой маленьких птичек под землю. В том случае, если канарейки прекращали петь, это означало, что следует немедленно подниматься наверх.
Открытие антибиотиков
Пожалуй, один из самых известных фактов о химии связан с открытием антибиотиков А. Флемингом в 1928 году. Ученый проводил один из своих рядовых экспериментов, которые были посвящены борьбе человеческого организма с различными бактериальными инфекциями. В пробирках он выращивал культуры под названием Staphylococcus. На несколько дней ученый случайно оставил пробирку с бактериями без внимания. В это время в ней выросла целая колония плесневых грибов. После этого А. Флеминг смог выделить отдельное активное вещество — пенициллин.
Впервые в истории человечества эти вещества были выделены из пшеничной муки итальянским ученым Бартоломео Беккари в 1728 году. Открытие ученого с той поры считается рождением целого направления в науке — химии белка. Рассмотрим несколько интересных фактов из химии о белках:
- Любой живой организм на нашей планете содержит в себе эти вещества. Белок составляет около половины сухого веса каждого организма. Например, у вирусов его содержание составляет от 50 до 95 %. Кроме того, белки являются одними из четырех главных компонентов живой материи (остальные три — это нуклеиновые кислоты, углеводы, а также жиры). Они занимают особое место по своим биологическим функциям.
- Порядка 30 % белков в организме человека находится в мышечной ткани. 20 % содержится в костях и сухожилиях.
 Всего 10% приходится на кожу.
Всего 10% приходится на кожу. - Всего в природе существует порядка тысячи разнообразных белков. Они обеспечивают возможность жизнедеятельности самых разных организмов — начиная с простейших и заканчивая человеком. Всего белки обеспечивают жизнь двум миллионам типов живых организмов.
- Мозг также является белком. При попадании в организм алкоголя нервные клетки погибают. Это происходит вследствие того, что белок денатурируется при взаимодействии с этиловым спиртом.
Еще шесть интересных фактов о химии
Рассмотрим вкратце еще несколько фактов из данной области, которые будут интересны как школьникам, так и взрослым.
- Рекордсменом среди ученых, посвятивших свои исследования открытию химических элементов, является шведский исследователь Карл Шееле. Он открыл фтор, хлор, барий, кислород, марганец, молибден, а также вольфрам.
- Самая тонкая материя, которая может быть увидена человеческим взглядом, — это мыльный пузырь. Толщина папиросной бумаги или, к примеру, человеческого волоса в тысячи раз больше, чем толщина стенки мыльного пузыря. Скорость его лопания составляет всего лишь 0,001 сек. Для сравнения: скорость ядерной реакции составляет 0.000 000 000 000 000 001 сек.
- Железо — это прочный и твердый материал, однако даже он может плавиться и превращаться в газ. Происходит это при температуре в 1539 0 С.
- Следующий интересный факт про химию связан с размером атомов. Известно, что эти частицы обладают чрезвычайно малыми размерами. К примеру, атомы водорода настолько малы, что даже если их разместить один за другим в количестве 100 миллионов штук, длина такой цепочки не будет превышать 1 см.
- В одной тонне воды Мирового океана содержится всего лишь 7 миллиграммов золота. Однако общая масса драгоценного металла, содержащегося во всех водах, достаточно внушительна и составляет 10 миллиардов тонн.
- Самые современные пассажирские самолеты в процессе своей работы используют до 75 тонн кислорода.
 Такое же количество данного вещества вырабатывается 25000-50000 га леса при фотосинтезе.
Такое же количество данного вещества вырабатывается 25000-50000 га леса при фотосинтезе.
Химические реакции являются частью повседневной жизни. Человек сталкивается с их продуктами буквально на каждом шагу, но вряд ли об этом задумывается. Мы собрали 10-ку самых зрелищных химических реакций, которые, развлекут взрослых, а детей, возможно, подтолкнут к изучению химии.
1. Натрий и вода в газообразном хлоре
Натрий является очень горючим элементом, и простое добавление воды может привести к взрыву. В видео показано, как каплю воды добавляют к небольшому кусочку натрия в колбе, заполненной газообразным хлором. Желтый цвет испускаемого света связан с работой натрия, который часто используется в системах уличном освещении. В эксперименте также выделяется большое количество тепла. А если объединить натрий и хлор, то получится хлорид натрия – обычная поваренная соль.2. Реакция магния и сухого льда
Магний воспламеняется очень легко и горит очень ярко. В этом эксперименте можно увидеть, как магний воспламеняется в оболочке из сухого льда — замороженного углекислого газа. Магний может гореть в двуокиси углерода и азоте. Из-за яркого света в процессе горения, магний использовался в при создании фотографических вспышек, и сейчас он все еще используется в морских сигнальных ракетах и фейерверках.3. Реакция хлората калия и конфеты
Хлорат калия представляет собой соединение, содержащее калий, хлор и кислород. Он часто используется в качестве дезинфицирующего средства, а также в фейерверками и взрывчатых веществах. Когда хлорат калия нагревают до температуры плавления, любой элемент, добавленный к нему, вызовет быстрый распад в виде взрыва (как видно на видео). В процессе этого распада выделяется кислород. Из-за этого хлорат калия часто используется в самолетах, космических станциях и подводных лодках в качестве источника кислорода.4. Эффект Мейснера
Когда сверхпроводник охлаждается до температуры ниже критического уровня, то он становится диамагнитным: т. е. он отталкивается от магнитного поля, а не притягивается к нему. Это открытие Мейснера привело к концепции магнитолевитационных поездов, когда поезд «парит» над рельсами, а не «использует колеса для езды».
е. он отталкивается от магнитного поля, а не притягивается к нему. Это открытие Мейснера привело к концепции магнитолевитационных поездов, когда поезд «парит» над рельсами, а не «использует колеса для езды».5. Перенасыщение ацетатом натрия
Ацетат натрия при нагревании или охлаждении становится пересыщенным. Когда он вступает в контакт с другим объектом, то снова кристаллизуется. Эта реакция также вызывает высокую температуру, поэтому она имеет практическое применение в создании тепловых прокладок. Ацетат натрия также используется в качестве консерванта, чем придает чипсам их уникальный вкус. Речь идет о пищевой добавке E262 или диацетате натрия.6. Сверхабсорбирующие полимеры
Сверхабсорбирующие полимеры (также известные как гидрогели) способны поглощать очень большие объемы жидкости по отношению к собственной массе. По этой причине, они используются в промышленном производстве подгузников, а также в других областях, требующих защиты от воды или жидкостей, к примеру при прокладке подземных кабелей.7. Плавающий гексафторид серы
Гексафторид серы представляет собой бесцветный, без запаха, нетоксичный и негорючий газ. Поскольку он в 5 раз плотнее воздуха, то этот газ можно наливать в открытые контейнеры, а легкие предметы будут плавать на нем, как на обычной воде. Еще одним забавным применением этого безобидного газа является то, что он при вдыхании резко понижает голос — полная противоположность гелия.8. Сверхтекучий гелий
При гелий охлаждается до минус 271 градуса по Цельсию, то он превращается в сверхтекучий гелий-II. Поскольку он проходит даже через даже сверхтонкие капилляры, то его вязкость невозможно измерить. Кроме того, гелий-II будет ползти вверх по стенкам контейнера в поисках более теплого места, что, как кажется, противоречит силе притяжения.
9. Термит и жидкий азот
Термит — порошкообразная смесь алюминия с оксидами различных металлов, которые производят так называемую термитную реакцию. Это не взрывчатое вещество, но оно может создавать короткие вспышки при очень высокой температуре. Горение при термитной реакции происходит при температуре в несколько тысяч градусов. В видео можно посмотреть попытку «погасить» термитную реакцию жидким азотом (минус 200 градусов).
Горение при термитной реакции происходит при температуре в несколько тысяч градусов. В видео можно посмотреть попытку «погасить» термитную реакцию жидким азотом (минус 200 градусов).10. Реакция Бриггса-Раушера
Реакция Бриггса-Раушера известна как осциллирующая химическая реакция. Свежеприготовленный бесцветный раствор медленно окрашивается в янтарный цвет, затем вдруг резко становится темно-синим. После этого он медленно становится бесцветным, и процесс повторяется примерно десять раз. Это связано с тем, что первая реакция создает определенные химические вещества, которые затем вызывают вторую реакцию, и процесс повторяется.Недавно с целью популяризации химии был запущен проект , разработчики которого хотели открыть сложный мир химических реакций и структур для широкой публики.
К концу 19 века как наука сформировалась органическая химия. Интересные факты помогут лучше понять окружающий мир и узнать, как делались новые научные открытия.
«Живое» блюдо
Первый интересный факт о химии касается необычной еды. Одно из известных блюд японской кухни — «Одори Дону» — «танцующий кальмар». Многих шокирует вид шевелящего щупальцами кальмара в тарелке. Но не стоит переживать, он не страдает и давно ничего не чувствует. Свежеосвежеванного кальмара помещают в чашу с рисом и перед подачей поливают соевым соусом. Щупальца кальмара начинают сокращаться. Это происходит из-за особого строения нервных волокон, которые на некоторое время после смерти животного вступают в реакцию с ионами натрия, содержащимися в соусе, заставляя мышцы сокращаться.
Случайное открытие
Интересные факты о химии часто касаются открытий, произведенных случайно. Так, в 1903 году Эдуард Бенедиктус, известный французский химик, изобрел небьющееся стекло. Ученый случайно уронил колбу, которая была заполнена нитроцеллюлозой. Он обратил внимание, что колба разбилась, но стекло не разлетелось на куски. Проведя необходимые исследования, химик установил, что подобным образом можно создать противоударное стекло. Так появились первые небьющиеся стекла для автомобилей, которые значительно снизили количество травм при автоавариях.
Так появились первые небьющиеся стекла для автомобилей, которые значительно снизили количество травм при автоавариях.
Живой датчик
Интересные факты про химию повествуют об использовании чувствительности животных для пользы человека. Вплоть до 1986 года шахтеры брали с собой под землю канареек. Дело в том, что эти птицы чрезвычайно чувствительны к рудничным газам, особенно метану и угарному газу. Даже при небольшой концентрации этих веществ в воздухе птица может погибнуть. Шахтеры прислушивались к пению птицы и следили за её самочувствием. Если канарейка проявляет беспокойство или начинает слабеть, это сигнал к тому, что шахту нужно покинуть.
Птица не обязательно погибала от отравления, на свежем воздухе ей быстро становилось лучше. Применялись даже специальные герметичные клетки, которые закрывались при признаках отравления. Даже сегодня не изобретен прибор, чувствующий рудные газы так же тонко, как канарейка.
Резина
Интересный факт о химии: ещё одно случайное изобретение — резина. Чарльз Гудьир, американский ученый, открыл рецепт приготовления резины, которая не плавится в жару и не ломается на морозе. Он случайно разогрел смесь серы и каучука, оставив его на плите. Процесс получения резины был назван вулканизацией.
Пенициллин
Ещё один интересный факт о химии: пенициллин был изобретен случайно. забыл о пробирке с бактериями стафилококка на несколько дней. А когда вспомнил о ней, то обнаружил, что колония погибает. Все дело оказалось в плесени, которая начала разрушать бактерии. Именно из ученый получил первый в мире антибиотик.
Полтергейст
Интересные факты о химии могут опровергать мистические истории. Часто можно услышать о старинных домах, наполненных привидениями. А все дело в устаревшей и плохо работающей системе отопления. Из-за утечки вызывающего отравление, у жителей дома возникают головные боли, а также слуховые и зрительные галлюцинации.
Серые кардиналы среди растений
Химия может объяснять поведение животных и растений. В ходе эволюции многие растения выработали механизмы защиты от травоядных. Чаще всего они растения выделяют яд, но ученые обнаружили и более тонкий метод защиты. Некоторые растения выделяют вещества, привлекающие… хищников! Хищники регулируют численность травоядных и отпугивают их от места произрастания «умных» растений. Такой механизм есть даже у привычных нам растений, таких как томаты и огурцы. Например, гусеница подточила огуречный листок, а запах выделившегося сока привлек птиц.
В ходе эволюции многие растения выработали механизмы защиты от травоядных. Чаще всего они растения выделяют яд, но ученые обнаружили и более тонкий метод защиты. Некоторые растения выделяют вещества, привлекающие… хищников! Хищники регулируют численность травоядных и отпугивают их от места произрастания «умных» растений. Такой механизм есть даже у привычных нам растений, таких как томаты и огурцы. Например, гусеница подточила огуречный листок, а запах выделившегося сока привлек птиц.
Защитники белки
Интересные факты: химия и медицина тесно связаны. Во время опытов над мышами вирусологи обнаружили интерферон. Этот белок продуцируется у всех позвоночных животных. Из зараженной вирусом клетки выделяется особый белок — интерферон. Он не обладает противовирусным действием, но контактирует со здоровыми клетками и делает их невосприимчивыми к вирусу.
Запах металла
Мы обычно думаем, что монетки, поручни в общественном транспорте, перила и т. д. пахнут металлом. Вот только этот запах выделяет не металл, а соединения, которые образуются в результате соприкосновения с металлической поверхностью органических веществ, например, человеческого пота. Для того чтобы человек почувствовал характерный запах, нужно совсем немного реагентов.
Строительный материал
Химия изучает белки сравнительно недавно. Они возникли более 4 миллиардов лет назад непостижимым образом. Белки являются строительным материалом для всех живых организмов, иные формы жизни науке неизвестны. Половину сухой массы у большинства живых организмов составляют белки.
В 1767 году заинтересовала природа пузырьков, которые выходят из пива во время брожения. Он собрал газ в чашу с водой, которую попробовал на вкус. Вода оказалась приятной и освежающей. Таким образом, ученый открыл углекислый газ, который сегодня используют для производства газированной воды. Через пять лет он описал более эффективный метод получения этого газа.
Заменитель сахара
Этот интересный факт о химии говорит о том, что многие научные открытия были сделаны практически случайно. Курьезный случай привел к обнаружению свойств сукралозы, современного заменителя сахара. Лесли Хью, профессор из Лондона, изучающий свойства нового вещества трихлорсахароза, дал указание своему помощнику Шашиканту Пхаднису протестировать его (test по-английски). Студент, плохо владеющий английским языком, понял это слово как «taste», что означает попробуй на вкус, и незамедлительно выполнил указание. Сукралоза оказалась очень сладкой.
Курьезный случай привел к обнаружению свойств сукралозы, современного заменителя сахара. Лесли Хью, профессор из Лондона, изучающий свойства нового вещества трихлорсахароза, дал указание своему помощнику Шашиканту Пхаднису протестировать его (test по-английски). Студент, плохо владеющий английским языком, понял это слово как «taste», что означает попробуй на вкус, и незамедлительно выполнил указание. Сукралоза оказалась очень сладкой.
Ароматизатор
Скатол — это органическое соединение, образующееся в кишечнике животных и человека. Именно это вещество обуславливает характерный запах фекалий. Но если в больших концентрациях скатол имеет запах каловых масс, то в малом количестве это вещество имеет приятный запах, напоминающий сливки или жасмин. Поэтому скатол используется для ароматизации парфюмерии, пищевых продуктов и табачных изделий.
Кот и йод
Интересный факт о химии — в открытии йода принимал непосредственное участие самый обычный кот. Фармацевт и химик Бернар Куртуа обычно обедал в лаборатории, и к нему часто присоединялся кот, любивший сидеть на плече хозяина. После очередной трапезы кот спрыгнул на пол, при этом опрокинув емкости с серной кислотой и суспензией золы водорослей в этаноле, стоявшие у рабочего стола. Жидкости смешались, и в воздух начал подниматься фиолетовый пар, оседавший на предметах мелкими черно-фиолетовыми кристаллами. Так был открыт новый химический элемент.
Химические реакции являются частью нашей повседневной жизни. Приготовление пищи на кухне, вождение автомобиля, эти реакции являются обычным явлением. В этом списке представлены самые удивительные и необычные реакции, которые большинство из нас никогда не видели.
10. Натрий и вода в газообразном хлоре
Натрий — очень горючий элемент. В этом видео мы видим, как к натрию в колбе с газообразным хлором добавляется капля воды. Желтый цвет — работа натрия. Если же объединить натрий и хлор, то получаем хлорид натрия, то есть обычную поваренную соль.
9. Реакция магния и сухого льда
Магний легко воспламеняется и горит очень ярко. В этом эксперименте вы видите, как магний воспламеняется в оболочке из сухого льда — замороженного углекислого газа. Магний может гореть в углекислом газе и азоте. Из-за яркого света в начале создания фотографии он использовался в качестве вспышки, сегодня он до сих пор используется в морских ракетах и фейерверках.
8. Реакция бертолетовой соли и сладости
Хлорат калия — это соединение калия, хлора и кислорода. Когда хлорат калия нагревают до температуры плавления, любой предмет, который вступит с ним в контакт в этот момент, будет способствовать распаду хлората, что проявится в виде взрыва. Газ, выступающий после распада, — это кислород. Из-за этого он часто используется в самолетах, на космических станциях и на подводных лодках в качестве источника кислорода. Пожар на станции Мир также был связан с этим веществом.
7. Эффект Мейснера
Когда сверхпроводник охлаждается до температуры ниже переходной, он становится диамагнитным: то есть предмет отталкивается от магнитного поля, а не притягивается к нему.
6. Перенасыщение ацетатом натрия
Да да, это легендарный ацетат натрия. Думаю, все уже не раз слышали о «жидком льде». Ну а больше добавить нечего)
5. Суперабсорбирующие полимеры
Также известные как гидрогель, они способны поглощать очень большое количество жидкости по отношению к своей собственной массе. По этой причине они используются в промышленном производстве подгузников, а также в других областях, где требуется защита от воды и других жидкостей, таких как сооружение подземных кабелей.
4. Плавающий гексафторид серы
Гексафторид серы — это бесцветный, нетоксичный и негорючий газ, у которого нет запаха. Так как он в 5 раз плотнее воздуха, его можно залить в контейнеры, а легкие предметы, погруженные в него, будут плавать, будто в воде. Еще одна забавная абсолютно безвредная особенность использования этого газа: он резко понижает голос, то есть получается эффект, с точностью до наоборот по сравнению с эффектом воздействия гелия. Эффект можно наблюдать здесь:
Эффект можно наблюдать здесь:
3. Сверхтекучий гелий
Когда гелий охлаждается до температуры -271 градус по Цельсию, он достигает точки лямбды. На этом этапе (в жидком виде) он известен как гелий II, при этом является сверхтекучим. Когда он проходит через самые тончайшие капилляры, невозможно измерить его вязкость. Кроме того, он будет «ползти» вверх в поисках теплой области, казалось бы, от воздействия гравитации. Невероятно!
2. Термит и жидкий азот
Нет, в этом видео не будут поливать термитов жидким азотом.
Термит — это алюминиевый порошок и оксид металла, которые производят алюминотермическую реакцию, известную как термитная реакция. Она не взрывоопасна, но в результате могут создаваться вспышки очень высокой температуры. С термитной реакции «начинаются» некоторые типы детонаторов, а горение происходит при температуре в несколько тысяч градусов. В представленном клипе мы видим попытки «охладить» термитную реакцию при помощи жидкого азота.
1. Реакция Бриггса — Раушера
Данная реакция известна как осциллирующая химическая реакция. По информации из Википедии: «свежеприготовленный бесцветный раствор медленно приобретает янтарный цвет, затем резко становится темно-синим, потом медленно вновь приобретает бесцветную окраску; процесс повторяется по кругу несколько раз, в итоге останавливается на темно-синем цвете, а сама жидкость сильно пахнет йодом». Причиной является то, что во время первой реакции вырабатываются определенные вещества, которые, в свою очередь, провоцируют вторую реакцию, и процесс повторяется до изнеможения.
Еще интересное:
Если вы считаете, что химия — очень скучная наука, тогда я советую вам посмотреть далее на 7 очень интересных и необычных химических реакций, которые точно вас удивят. Возможно, гифки в продолжении поста смогут вас переубедить, и вы перестанете думать, что химия — это скучно;) Смотрим далее.
Гипнотизирующая бромноватая кислота
Согласно науке, реакция Белоусова-Жаботинского – это «колебательная химическая реакция», в ходе которой «ионы металлов переходной группы катализируют окисление различных, обычно органических, восстановителей бромноватой кислотой в кислой водной среде», что позволяет «наблюдать невооруженным глазом образование сложных пространственно-временных структур». Это научное объяснение гипнотического явления, которое происходит, если бросить немного брома в кислотный раствор.
Это научное объяснение гипнотического явления, которое происходит, если бросить немного брома в кислотный раствор.
Кислота превращает бром в химическое вещество под названием бромид (который приобретает совершенно другой оттенок), в свою очередь, бромид быстро превращается обратно в бром, потому что научные эльфы, живущие внутри него – чересчур упрямые засранцы. Реакция повторяется снова и снова, позволяя вам бесконечно наблюдать за движением невероятных волнообразных структур.
Прозрачные химические вещества мгновенно становятся черными
Вопрос: что произойдет, если смешать сульфит натрия, лимонную кислоту и натрия йодид?
Правильный ответ внизу:
Когда вы смешиваете вышеупомянутые ингредиенты в определенных пропорциях, в конечном счете получается капризная жидкость, которая поначалу имеет прозрачный цвет, а после резко становится черной. Этот эксперимент называется «Йодные часы». Попросту говоря, данная реакция происходит тогда, когда специфические компоненты соединяются таким образом, чтобы их концентрация постепенно менялась. Если она достигает определенного порога – жидкость приобретает черный цвет.
Но это еще не все. За счет изменения пропорции ингредиентов у вас есть возможность получить обратную реакцию:
Кроме того, при помощи различных веществ и формул (например, как вариант – реакция Бриггса-Раушера) вы можете создать шизофреническую смесь, которая постоянно будет менять свой цвет с желтого на голубой.
Создание плазмы в микроволновке
Вы хотите затеять с вашим другом что-нибудь интересное, но у вас нет доступа к куче непонятных химических веществ или элементарных знаний, необходимых для того, чтобы смешать их безопасно? Не отчаиваетесь! Все, что вам понадобится для проведения данного эксперимента – это виноград, нож, стакан и микроволновка. И так, возьмите виноградинку и разрежьте ее напополам. Один из кусочков снова разделите ножом на две части так, чтобы эти четвертинки остались связанными кожурой. Поместите их в микроволновку и накройте перевернутым стаканом, включите печь. Затем сделайте шаг назад и наблюдайте за тем, как инопланетяне похищают разрезанную ягодку.
Поместите их в микроволновку и накройте перевернутым стаканом, включите печь. Затем сделайте шаг назад и наблюдайте за тем, как инопланетяне похищают разрезанную ягодку.
На самом деле, то, что происходит на ваших глазах – это один из способов создания очень незначительного количества плазмы. Еще со школы вы знаете, что существует три состояния вещества: твердое, жидкое и газообразное. Плазма, по сути, является четвертым типом и представляет собой ионизированный газ, полученный в результате перегревания обычного газа. Виноградный сок, оказывается, богат ионами, и поэтому является одним из самых лучших и доступных средств для проведения простых научных экспериментов.
Тем не менее, будьте осторожны, пытаясь создать плазму в микроволновке, поскольку озон, который образуется внутри стакана, в больших количествах может быть токсичным!
Зажигание потухшей свечи через дымный след
Этот трюк вы можете попытаться повторить в домашних условиях без риска взрыва гостиной или же всего дома. Зажгите свечу. Задуйте ее и сразу же поднесите огонь к дымному следу. Поздравляем: у вас получилось, теперь вы настоящий мастер огня.
Оказывается, между огнем и свечным воском существует некая любовь. И это чувство намного сильнее, чем вы думаете. Неважно, в каком состоянии находится воск – жидком, твердом, газообразном – огонь все равно его найдет, настигнет и сожжет ко всем чертям.
Кристаллы, которые светятся во время дробления
Перед вами химическое вещество под названием европий-тетракис, демонстрирующее эффект триболюминесценции. Впрочем, лучше раз увидеть, чем сто раз прочитать.
Данный эффект возникает при разрушении кристаллических тел благодаря преобразованию кинетической энергии непосредственно в свет.
Если вы хотите все это увидеть собственными глазами, но под рукой у вас нет европия-тетракиса, не беда: подойдет даже самый обычный сахар. Просто сядьте в темной комнате, положите в блендер несколько кубиков сахара и наслаждайтесь красотой фейерверка.
Еще в XVIII веке, когда многие люди думали, что научные явления вызывают призраки или ведьмы или призраки ведьм, ученые использовали этот эффект, чтобы подшутить над «простыми смертными», разжевывая в темноте сахар и смеясь над теми, кто бежал от них как от огня.
Адское чудовище, появляющееся из вулкана
Тиоцианат ртути (II) – на вид невинный белый порошок, но стоит его поджечь, как он тут же превращается в мифическое чудовище, готовое поглотить вас и весь мир целиком.
Вторая реакция, изображенная ниже, вызвана сгоранием дихромата аммония, в результате которого образуется миниатюрный вулкан.
Ну а что будет, если смешать два вышеупомянутых химических вещества и поджечь их? Смотрите сами.
Однако не пытайтесь повторить эти эксперименты дома, поскольку и тиоцианат ртути (II), и дихромат аммония являются очень токсичными и при сгорании могут нанести серьезный вред вашему здоровью. Берегите себя!
Ламинарное течение
Если вы смешаете кофе с молоком, у вас получится жидкость, которую вы вряд ли когда-нибудь снова сможете разделить на составные компоненты. И это касается всех веществ, находящихся в жидком состоянии, верно? Верно. Но есть такое понятие, как ламинарное течение. Чтобы увидеть это волшебство в действии, достаточно поместить несколько капель разноцветных красителей в прозрачный сосуд с кукурузным сиропом и аккуратно все перемешать…
… а затем снова перемешать в том же темпе, но только теперь в обратном направлении.
Ламинарное течение может происходить в любых условиях и с использованием различных типов жидкостей, однако в данном случае такое необычное явление обусловлено вязкими свойствами кукурузного сиропа, который при смешивании с красителями образует разноцветные слои. Так что, если вы так же аккуратно и не спеша выполните действие в обратном направлении, все вернется на прежние места. Похоже на путешествие во времени!
Интересные факты химия Габриелян О.
 С. 7-11 классы.
С. 7-11 классы.1. Современные пассажирские самолеты во время девятичасового полета используют от 50 до 75 тонн кислорода. Столько же этого вещества вырабатывает 25000-50000 гектаров леса в процессе фотосинтеза.
2. Один литр морской воды содержит 25 граммов соли.
3. Атомы водорода настолько малы, что если их в количестве 100 миллионов разместить в цепочку друг за другом, получится длина лишь в один сантиметр.
4. В одной тонне воды Мирового океана содержится 7 миллиграмм золота. Общая же сумма данного драгоценного металла в водах океанов составляет 10 миллиардов тонн.
5. В человеческом организме примерно 65-75% воды. Она используется системами органов для транспортировки полезных веществ, регуляции температуры и растворения питательных соединений.
6. Интересные факты о химии касаются нашей планеты Земля. К примеру, за последних 5 веков ее масса увеличилась на целый миллиард тонн. Такой вес прибавили космические вещества.
7. Стенки мыльного пузыря – пожалуй, самая тонкая материя, которую человек способен увидеть невооруженным взглядом. Для примера, толщина папиросной бумаги или волоса в несколько тысяч раз толще.
8. Скорость лопания мыльного пузыря составляет 0.001 секунды. Скорость ядерной реакции – 0.000 000 000 000 000 001 секунды.
9. Железо, очень твердый и прочный материал в обычном его состоянии, становится газообразным при температуре 5 тысяч градусов Цельсия.
10. Всего за минуту Солнце вырабатывает энергии больше, чем наша планета расходует за целый год. Но мы не используем ее полностью. 19% солнечной энергии поглощает атмосфера, 34% возвращается в космос, а лишь 47% доходит до Земли.
11. Как ни странно, но лучше, чем воздух звук проводит гранит. Так, если бы между людьми была бы гранитная стена (сплошная), они бы слышали звуки на расстоянии одного километра. В обычной жизни в подобных условиях звук распространяется лишь на сто метров.
12. Шведский ученый Карл Шелле является рекордсменом по количеству открытых химических элементов. На его счету хлор, фтор, барий, вольфрам, кислород, марганец, молибден.
Второе место разделили шведы Яком Берцелиус, Карл Монсандер, англичанин Гемфри Дэви и француз Поль Лекок де Буабордан. Им принадлежит открытие четверти всех известных современной науке элементов (то есть по 4 каждый).
13. Самый крупный самородок из платины – так называемый «Уральский гигант». Его вес составляет 7 килограммов и 860,5 граммов. Хранится этот гигант в Алмазном фонде Московского Кремля.
14. 16 сентября с 1994 года – Международный день охраны озонового слоя, согласно указу Генеральной ассамблеи ООН.
15. Углекислый газ, который широко используется для создания современных газированных напитков, был открыт английским учёным Джозефом Пристли еще в 1767 году. Тогда Пристли заинтересовали пузырьки, образуемые при брожении пива.
16. Танцующий кальмар – так называется удивительное блюдо в Японии. Недавно пойманного и убитого кальмара кладут в миску с рисом и перед клиентом поливают соевым соусом. При взаимодействии с натрием, который содержится в соевом соусе, нервные окончания даже убитого кальмара начинают реагировать. В результате такой химической реакции моллюск начинает «танцевать» прямо в тарелке.
17. Скатол – органическое соединение, которое отвечает за характерный запах фекалий. Интересен тот факт, что в больших дозах данное вещество имеет приятный цветочный аромат, который используют в пищевой промышленности и парфюмерии.
Интересные факты о веществах в химии. Интересная органическая химия, которая не оставит тебя равнодушным
Как вещества, как известно, состоят из атомов. А разные виды атомов называются химическими элементами. В этом посте вы прочитаете множество интересных фактов о химических элементах.
Химических элементов значительно меньше, чем разных веществ. Стабильных элементов (атомы которых не распадаются со временем) всего 80, а также есть ещё несколько радиоактивных, но долгоживущих, которые тоже встречаются в природе. Всё многообразие веществ образуется из-за того, что атомы способны соединяться между собой. Положительно заряженные ядра атомов при сближении притягивают отрицательно заряженные электроны других атомов и из-за этого между атомами образуется устойчивая связь.
Атомы химических элементов отличаются друг от друга числом протонов в ядре атома. Протоны и нейтроны удерживаются в ядре ядерными силами, но электромагнитные силы пытаются отталкивать протоны друг от друга. Чем больше протонов в ядре, тем сильнее отталкивание, поэтому слишком большие ядра не могут долго существовать. Самый последний из химических элементов, атомы которого стабильны — свинец (номер 82), а самый последний, который встречается в природе — уран (номер 92). Все известные элементы с большими номерами получены искусственно в ядерных реакторах или на ускорителях. Самый же тяжёлый на сегодняшний день элемент, который получен искусственно, это унуноктий (номер 118). Его синтезировали российские учёные на ускорителе в Дубне. Все элементы с номером 100 и выше получены в очень малых количествах (иногда лишь в количестве нескольких атомов).
Согласно современным представлениям все элементы тяжелее водорода и гелия образовались в процессе эволюции звёзд. Ядра атомов от водорода до железа способны сливаться друг с другом с выделением энергии и постепенно образуются в течение жизни звезды. А вот все химические элементы, атомы которых тяжелее железа, как считают учёные, образовались при взрывах сверхновых или нейтронных звёзд.
Самый первый химический элемент — водород. Он является самым распространённым во Вселенной, более 90% атомов — это атомы водорода. Но на Земле водорода не так много, а самый распространённый элемент — кислород. В земной коре около 50% кислорода, затем идут кремний (26% по массе) и алюминий (7%).
Даже чистые химические элементы могут существовать в виде разных веществ, т к. атомы в них могут соединяться по-разному. Это явление называется аллотропией.
пример аллотропии — кристаллический бор (слева) и аморфный бор
Химические элементы очень сильно отличаются друг от друга по способности вступать в химические реакции. Самые химически пассивные элементы — инертные газы, особенно гелий. Всё потому, что у них полностью заполнена внешняя электронная оболочка. Гелий и неон вообще не образуют настоящих химических соединений. Также малой химической активностью отличаются т. н. благородные металлы — золото, серебро, платина и металлы платиновой группы.
Самые активные химические элементы — те, которые легко отдают или присоединяют электроны. Самый активный металл — цезий, а самый активный неметалл — фтор.
Цезий настолько активен, что самопроизвольно загорается на воздухе и взрывается в воде.
видео — реакция цезия с водой (сначала в воду бросают рубидий, а потом цезий)
Фтор настолько активен, что реагирует почти со всеми известными веществами. В этом газе загораются даже такие вещества, как песок и вода. Фтор настолько опасен, что многие химики, пытаясь получить его в чистом виде, погибли во время опытов.
видео — горение асбеста и воды во фторе
видео — даже кирпич загорается во фторе
Из всех химических элементов в чистом виде 11 элементов при нормальных условиях — газы, а почти все остальные — твёрдые вещества. Лишь ртуть и бром — жидкости.
По своим свойствам многие химические элементы в чём-то похожи друг на друга. Например, среди них выделяют такие группы, как щелочные металлы, галогены, инертные газы и т. д. В то же время практически любой известный химический элемент в чём-то уникален и в некоторых областях применения незаменим. Например, титан, на основе которого делают сверхпрочные сплавы, незаменим в авиастроении. Кремний незаменим в микроэлектронике. Литий незаменим в производстве компактных аккумуляторов. Цезий незаменим как материал для инфракрасных датчиков. Уран незаменим в атомной промышленности.
д. В то же время практически любой известный химический элемент в чём-то уникален и в некоторых областях применения незаменим. Например, титан, на основе которого делают сверхпрочные сплавы, незаменим в авиастроении. Кремний незаменим в микроэлектронике. Литий незаменим в производстве компактных аккумуляторов. Цезий незаменим как материал для инфракрасных датчиков. Уран незаменим в атомной промышленности.
Организм человека состоит из более, чем 30 химических элементов, при недостатке которых он не может нормально функционировать. Например, из соединений кальция состоят кости, железо входит в состав гемоглобина крови, йод нужен для синтеза гормонов щитовидной железы и т. д.
Как несовершенное знание английского языка помогло открыть один из заменителей сахара?
Один из самых эффективных заменителей сахара — сукралоза — был открыт случайно. Профессор Лесли Хью из Королевского колледжа в Лондоне дал указание работавшему с ним студенту Шашиканту Пхаднису испытать (по-английски «test») полученное в лаборатории вещество трихлорсахароза. Студент знал английский на далёком от совершенства уровне и вместо «test» услышал «taste», немедленно попробовав вещество на вкус и найдя его очень сладким.
Какая деталь автомобиля была изобретена случайно?
Небьющееся стекло было изобретено случайно. В 1903 году французский химик Эдуард Бенедиктус нечаянно уронил колбу, заполненную нитроцеллюлозой. Стекло треснуло, но не разлетелось на мелкие кусочки. Поняв, в чём дело, Бенедиктус изготовил первые лобовые стёкла современного типа, чтобы уменьшить количество жертв автомобильных аварий.
Кем по профессии был человек, названный москвичами в легендах светящимся монахом?
Академик Семён Вольфкович был в числе первых советских химиков, проводивших опыты с фосфором. Тогда необходимые меры предосторожности ещё не принимались, и газообразный фосфор в ходе работы пропитывал одежду. Когда Вольфкович возвращался домой по тёмным улицам, его одежда излучала голубоватое свечение, а из-под ботинок высекались искры. Каждый раз за ним собиралась толпа и принимала учёного за потустороннее существо, что привело к распространению по Москве слухов о «светящемся монахе».
Каждый раз за ним собиралась толпа и принимала учёного за потустороннее существо, что привело к распространению по Москве слухов о «светящемся монахе».
Как Менделеев открыл периодический закон?
Широко распространена легенда, что мысль о периодической таблице химических элементов пришла к Менделееву во сне. Однажды его спросили, так ли это, на что учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Какому знаменитому физику вручили Нобелевскую премию в области химии?
Эрнест Резерфорд занимался исследованиями в основном в области физики и однажды заявил, что «все науки можно разделить на две группы — на физику и коллекционирование марок». Однако Нобелевскую премию ему вручили по химии, что стало неожиданностью как для него, так и для других учёных. Впоследствии он замечал, что из всех превращений, которые ему удалось наблюдать, «самым неожиданным стало собственное превращение из физика в химика».
Какие птицы помогали шахтёрам?
Канарейки очень чувствительны к содержанию в воздухе метана. Эту особенность использовали в своё время шахтёры, которые, спускаясь под землю, брали с собой клетку с канарейкой. Если пения давно не было слышно, значит следовало подниматься наверх как можно быстрее.
Как была открыта вулканизация?
Американец Чарльз Гудьир случайно открыл рецепт изготовления резины, которая не размягчается в жару и не становится хрупкой на морозе. Он по ошибке нагрел смесь каучука и серы на кухонной плите (по другой версии, оставил образец резины у печи). Этот процесс получил название вулканизация.
Какие существа виновны в цвете Кровавого водопада в Антарктиде?
В Антарктиде из ледника Тейлора временами выходит Кровавый водопад. Вода в нём содержит двухвалентное железо, которое, соединяясь с атмосферным воздухом, окисляется и образует ржавчину. Это и придаёт водопаду кроваво-рыжий цвет. Однако двухвалентное железо в воде возникает не просто так — его производят бактерии, живущие в изолированном от внешнего мира водоёме глубоко подо льдом. Эти бактерии сумели организовать жизненный цикл при полном отсутствии солнечного света и кислорода. Они перерабатывают остатки органики, а «дышат» трёхвалентным железом из окружающих пород.
Однако двухвалентное железо в воде возникает не просто так — его производят бактерии, живущие в изолированном от внешнего мира водоёме глубоко подо льдом. Эти бактерии сумели организовать жизненный цикл при полном отсутствии солнечного света и кислорода. Они перерабатывают остатки органики, а «дышат» трёхвалентным железом из окружающих пород.
Ближайший предмет химии составляет изучение однородных веществ, из сложения которых составлены все тела мира, превращений их друг в друга и явлений, сопровождающих такие превращения.
— Д.И. Менделеев
Для всех любителей химии, редакция сайта
Self Hacker , приготовила небольшую подборку интересных фактов про химию.Начнем с одного из актуальных вопросов, который касается химии, как науки.
В каком случае этиловый спирт может служить противоядием?Метиловый спирт по вкусу и запаху неотличим от этилового, однако его действие на организм гораздо более угрожающей для нашего здоровья. Даже небольшое количество метанола может привести к слепоте, а доза от 30 мл — к смерти.
Этим объясняются частые случаи отравления метиловым спиртом либо по незнанию, либо в случае употребления поддельного алкоголя. Интересно то, что в случае такого отравления противоядием является обычный, то есть этиловый спирт. Это связано с тем, что процессы связывания обоих спиртов в организме происходят с участием одного фермента — алкогольдегидрогеназы, но так как реакция с этанолом происходит быстрее, вредных продуктов расщепления метанола в крови в результате оказывается намного меньше.
Предлагаем вам посмотреть видео, как получают пенопласт — интересно и информативно.
Гидрогель для сращивания переломов, заслуженный изобретение в химической промышленности.Биоинженеры из Университета Райса создали гидрогель, который мгновенно переходит из жидкого состояния в полутвердий при температуре, близкой к температуре тела человека, а затем разрушается с подходящей скоростью. Гель может применяться в качестве поддержки для сломанных костей или других тканей в организме пациента. При комнатной температуре гидрогель остается жидким, но при попадании в тело пациента он затвердевает и заполняет свободное пространство, которое позже зарастет естественной тканью.
Гель может применяться в качестве поддержки для сломанных костей или других тканей в организме пациента. При комнатной температуре гидрогель остается жидким, но при попадании в тело пациента он затвердевает и заполняет свободное пространство, которое позже зарастет естественной тканью.
Также гидрогель может применяться для доставки стволовых клеток в скелетных дефектов, что должно вызывать ускоренную регенерацию костной ткани. После выполнения своих функций гель разлагается и выводится из организма. Авторы открытия ожидают, что гель можно будет настроить таким образом, чтобы скорость его разложения соответствовала различным темпам роста кости.
А теперь интересные факты по химии, которые вы точно не знали:
- Например, когда мы режем лук и «плачем» — то заслуга этих фиктивных эмоций принадлежит именно сере, которая впитывается в почву, где растет лук.
- В провинции Индонезии существует вулкан, полностью заполненный серой, который носит название Кава Иджен. Она оседает на трубах, после чего рабочие сбивают ее арматурой и несут на взвешивание. Там таким образом они зарабатывают себе на жизнь.
- Гигиенические «продукты» на основе серы созданные специально для чистки проблемной кожи от угрей и сыпи.
- Ушная сера, которую нас приучили удалять еще с детства ватными тампонами, «отравляет» жизнь с благородными намерениями. В ней содержатся особые ферменты лізозіма; именно они «не пускают» в наш организм все бактерии.
- В 1985 году группа американских и английских исследователей открыли молекулярные соединения из углерода, которые сильно напоминают своей формой футбольный мяч. В честь него и хотели назвать открытие, однако ученые не договорились, какой термин использовать — football или soccer (срок футбола в США). В итоге соединение назвали фуллеренами в честь архитектора Фуллера, который придумал геодезический купол, составленный из тетраэдров.
- Французский химик, аптекарь и врач Никола Лемери (1645-1715) в свое время наблюдал нечто похожее на вулкан, когда, смешав в железной чашке 2 г железных опилок и 2 г порошкообразной серы, прикоснувшись к ней раскаленной стеклянной палочкой.
 Через некоторое время из приготовленной смеси начали вылетать частицы черного цвета, и сама она, сильно увеличившись в объеме, так разогрелась, что начала светиться.
Через некоторое время из приготовленной смеси начали вылетать частицы черного цвета, и сама она, сильно увеличившись в объеме, так разогрелась, что начала светиться. - Выделение газообразного фтора с фторсодежмих веществ оказалось одним из самых трудных экспериментальных задач. Фтор имеет исключительную реакционную способность; причем часто его взаимодействие с другими веществами происходит с воспламенением и взрывом.
- Йод открыл в 1811 французский химик Б. Куртуа Существует такая версия открытия йода. В соответствии с ней, виновником открытия Куртуа был любимый кот: он лежал на плече химика, когда тот работал в лаборатории. Желая развлечься, кот прыгнул на стол и столкнул на пол сосуды, которые стояли рядом. В одной из них находился спиртовой раствор золы морских водорослей, а в другом — серная кислота. После смешения жидкостей появилось облако сине-фиолетового пара, было не чем иным как йодом.
- В головном мозге человека за одну секунду происходит 100 000 химических реакций
- В 1903 году в американском штате Канзас из нефтяной скважины внезапно забил фонтан газа. На большое удивление нефтяников, газ оказался негорючим. Новая встреча с ним пришлась на годы Первой мировой войны. В немецкий дирижабль, который сбрасывает бомбы на Лондон, попал зажигательный снаряд, но дирижабль не вспыхнул. Медленно истекая газом, он улетел прочь. Секретные службы Англии переполошились: до этого немецкие дирижабли взрывались от попадания снарядов, так как были наполнены водородом. Эксперты-химики вспомнили, что задолго до войны немецкие пароходы почему-то везли, как балласт монацитовий песок из Индии и Бразилии. Этим газом был гелий. В монацитовому песка, который долгое время был главным гелійовмісною сырьем, содержится радиоактивный элемент торий, при распаде которого образуется гелий, который по плотности уступает только водороду, но имеет перед водородом преимущество: он негорюч и химически инертен.
На этом закончим наши интересные факты про такую науку, как. Если вам известны интересные факты из области химии, то пишите их нам в комментарии и мы обязательно внесем их в наш список.
Если вам известны интересные факты из области химии, то пишите их нам в комментарии и мы обязательно внесем их в наш список.
К концу 19 века как наука сформировалась органическая химия. Интересные факты помогут лучше понять окружающий мир и узнать, как делались новые научные открытия.
«Живое» блюдо
Первый интересный факт о химии касается необычной еды. Одно из известных блюд японской кухни — «Одори Дону» — «танцующий кальмар». Многих шокирует вид шевелящего щупальцами кальмара в тарелке. Но не стоит переживать, он не страдает и давно ничего не чувствует. Свежеосвежеванного кальмара помещают в чашу с рисом и перед подачей поливают соевым соусом. Щупальца кальмара начинают сокращаться. Это происходит из-за особого строения нервных волокон, которые на некоторое время после смерти животного вступают в реакцию с ионами натрия, содержащимися в соусе, заставляя мышцы сокращаться.
Случайное открытие
Интересные факты о химии часто касаются открытий, произведенных случайно. Так, в 1903 году Эдуард Бенедиктус, известный французский химик, изобрел небьющееся стекло. Ученый случайно уронил колбу, которая была заполнена нитроцеллюлозой. Он обратил внимание, что колба разбилась, но стекло не разлетелось на куски. Проведя необходимые исследования, химик установил, что подобным образом можно создать противоударное стекло. Так появились первые небьющиеся стекла для автомобилей, которые значительно снизили количество травм при автоавариях.
Живой датчик
Интересные факты про химию повествуют об использовании чувствительности животных для пользы человека. Вплоть до 1986 года шахтеры брали с собой под землю канареек. Дело в том, что эти птицы чрезвычайно чувствительны к рудничным газам, особенно метану и угарному газу. Даже при небольшой концентрации этих веществ в воздухе птица может погибнуть. Шахтеры прислушивались к пению птицы и следили за её самочувствием. Если канарейка проявляет беспокойство или начинает слабеть, это сигнал к тому, что шахту нужно покинуть.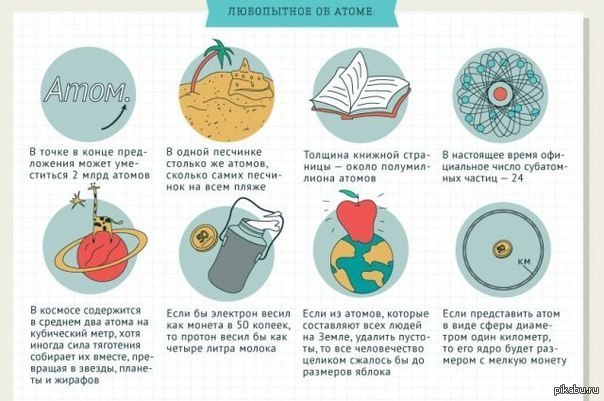
Птица не обязательно погибала от отравления, на свежем воздухе ей быстро становилось лучше. Применялись даже специальные герметичные клетки, которые закрывались при признаках отравления. Даже сегодня не изобретен прибор, чувствующий рудные газы так же тонко, как канарейка.
Резина
Интересный факт о химии: ещё одно случайное изобретение — резина. Чарльз Гудьир, американский ученый, открыл рецепт приготовления резины, которая не плавится в жару и не ломается на морозе. Он случайно разогрел смесь серы и каучука, оставив его на плите. Процесс получения резины был назван вулканизацией.
Пенициллин
Ещё один интересный факт о химии: пенициллин был изобретен случайно. забыл о пробирке с бактериями стафилококка на несколько дней. А когда вспомнил о ней, то обнаружил, что колония погибает. Все дело оказалось в плесени, которая начала разрушать бактерии. Именно из ученый получил первый в мире антибиотик.
Полтергейст
Интересные факты о химии могут опровергать мистические истории. Часто можно услышать о старинных домах, наполненных привидениями. А все дело в устаревшей и плохо работающей системе отопления. Из-за утечки вызывающего отравление, у жителей дома возникают головные боли, а также слуховые и зрительные галлюцинации.
Серые кардиналы среди растений
Химия может объяснять поведение животных и растений. В ходе эволюции многие растения выработали механизмы защиты от травоядных. Чаще всего они растения выделяют яд, но ученые обнаружили и более тонкий метод защиты. Некоторые растения выделяют вещества, привлекающие… хищников! Хищники регулируют численность травоядных и отпугивают их от места произрастания «умных» растений. Такой механизм есть даже у привычных нам растений, таких как томаты и огурцы. Например, гусеница подточила огуречный листок, а запах выделившегося сока привлек птиц.
Защитники белки
Интересные факты: химия и медицина тесно связаны. Во время опытов над мышами вирусологи обнаружили интерферон. Этот белок продуцируется у всех позвоночных животных. Из зараженной вирусом клетки выделяется особый белок — интерферон. Он не обладает противовирусным действием, но контактирует со здоровыми клетками и делает их невосприимчивыми к вирусу.
Этот белок продуцируется у всех позвоночных животных. Из зараженной вирусом клетки выделяется особый белок — интерферон. Он не обладает противовирусным действием, но контактирует со здоровыми клетками и делает их невосприимчивыми к вирусу.
Запах металла
Мы обычно думаем, что монетки, поручни в общественном транспорте, перила и т. д. пахнут металлом. Вот только этот запах выделяет не металл, а соединения, которые образуются в результате соприкосновения с металлической поверхностью органических веществ, например, человеческого пота. Для того чтобы человек почувствовал характерный запах, нужно совсем немного реагентов.
Строительный материал
Химия изучает белки сравнительно недавно. Они возникли более 4 миллиардов лет назад непостижимым образом. Белки являются строительным материалом для всех живых организмов, иные формы жизни науке неизвестны. Половину сухой массы у большинства живых организмов составляют белки.
В 1767 году заинтересовала природа пузырьков, которые выходят из пива во время брожения. Он собрал газ в чашу с водой, которую попробовал на вкус. Вода оказалась приятной и освежающей. Таким образом, ученый открыл углекислый газ, который сегодня используют для производства газированной воды. Через пять лет он описал более эффективный метод получения этого газа.
Заменитель сахара
Этот интересный факт о химии говорит о том, что многие научные открытия были сделаны практически случайно. Курьезный случай привел к обнаружению свойств сукралозы, современного заменителя сахара. Лесли Хью, профессор из Лондона, изучающий свойства нового вещества трихлорсахароза, дал указание своему помощнику Шашиканту Пхаднису протестировать его (test по-английски). Студент, плохо владеющий английским языком, понял это слово как «taste», что означает попробуй на вкус, и незамедлительно выполнил указание. Сукралоза оказалась очень сладкой.
Ароматизатор
Скатол — это органическое соединение, образующееся в кишечнике животных и человека. Именно это вещество обуславливает характерный запах фекалий. Но если в больших концентрациях скатол имеет запах каловых масс, то в малом количестве это вещество имеет приятный запах, напоминающий сливки или жасмин. Поэтому скатол используется для ароматизации парфюмерии, пищевых продуктов и табачных изделий.
Именно это вещество обуславливает характерный запах фекалий. Но если в больших концентрациях скатол имеет запах каловых масс, то в малом количестве это вещество имеет приятный запах, напоминающий сливки или жасмин. Поэтому скатол используется для ароматизации парфюмерии, пищевых продуктов и табачных изделий.
Кот и йод
Интересный факт о химии — в открытии йода принимал непосредственное участие самый обычный кот. Фармацевт и химик Бернар Куртуа обычно обедал в лаборатории, и к нему часто присоединялся кот, любивший сидеть на плече хозяина. После очередной трапезы кот спрыгнул на пол, при этом опрокинув емкости с серной кислотой и суспензией золы водорослей в этаноле, стоявшие у рабочего стола. Жидкости смешались, и в воздух начал подниматься фиолетовый пар, оседавший на предметах мелкими черно-фиолетовыми кристаллами. Так был открыт новый химический элемент.
Достижения этой науки окружают человека всюду: от лекарств и антипригарных сковородок до магическим образом исчезающих чернил на чеках. Химия тяжело дается школьникам – возможно, она неинтересна? Ничего подобного! В статье подобраны самые любопытные факты о химии и химиках. Узнайте о самом известном московском привидении, о том, как сварливая жена помогла изобрести резину и о главной ценности острова Итуруп.
Растворить и перемешать
Царская водка – это не напиток монархов, а смесь, состоящая на четверть из азотной и на три четверти из соляной кислот. Эта жидкость насыщенного морковного цвета растворяет даже такие плохо поддающиеся травлению металлы, как золото и платина.
Кислота «Царская водка»
В 1940 году царская водка спасла от уничтожения нобелевские медали двух немецких физиков: Джеймса Франка и Макса фон Лауэ. Нацисты запрещали принимать эту награду, потому что ее имел непримиримый оппонент национал-социалистических идей Карл фон Осецкий. Химики копенгагенского Института Нильса Бора бросили медали в бутыль с царской водкой и даже поставили емкость на видное место.
Награды растворились бесследно. Сотрудники абвера ходили мимо и ничего не заметили. После войны золото было извлечено из кислоты, а медали отлиты заново.
Исчезающая ложка
«Ложки нет», — говорил Нео из фильма «Матрица», ожидая приема у пророчицы. Но даже он был бы удивлен, если бы к чаю с печеньем пророчица подала бы приборы из галлия.
Чтобы расплавить этот металл, доменная печь не нужна. Его достаточно подогреть до 28 градусов, и он потечет. Даже в руках галлий тает, как мороженое, что уж говорить о кипятке!
Светящийся монах и собака Баскервилей
Морда собаки Баскервилей из повести была вымазана фосфором в преступных целях. А советский академик Семён Вольфкович, рьяно изучавший этот элемент, просто пренебрегал техникой безопасности. В результате его костюм и обувь пропитались газообразным фосфором.
Идя домой по ночной Москве, Вольфкович излучал мистическое свечение. За ученым на почтительном расстоянии каждый раз шли изумленные люди, которым «светящийся монах» внушал одновременно ужас и любопытство.
Химия и призраки
Кентервильское привидение и множество призраков, населяющих Хогвартс, – не совсем выдумки. До сих пор тысячи обитателей старинных домов и замков жалуются на заунывные голоса и таинственные шаги в темноте, не могут нормально спать и даже продают особняки.
Виновник ночных кошмаров найден: им оказался угарный газ. Устаревшая конструкция отопления в домах прошлых столетий выпускает его в комнаты в таком количестве, которое вызывает слуховые и зрительные галлюцинации.
Можно ли ходить по воде
Можно, если это не чистая вода, а смесь ее с крахмалом. Если налить такую крахмальную суспензию в бассейн, то она будет вести себя как жидкость. Но стоит резко ударить по ее поверхности или даже прыгнуть на нее, как она мгновенно загустеет под ногами, а потом снова растечется. Быстро бегущий человек буквально прокладывает себе твердую дорожку на жидкости.
Дело в том, что вязкость крахмальной суспензии зависит не только от температуры, но и от применения силы. Таким же образом ведут себя сливки, густеющие при взбивании. А вот кетчуп, наоборот, соизволит потечь только после удара по бутылке.
Таким же образом ведут себя сливки, густеющие при взбивании. А вот кетчуп, наоборот, соизволит потечь только после удара по бутылке.
Рекордсмены периодической системы
Созданная таблица элементов – альфа и омега химической науки. В ней много интересного, поищем в ее клеточках самые необычные экземпляры:
- астат – наиболее редкий из встречающихся в природе элементов: на всей планете его менее 1 г;
- рений – самый редкий металл: для получения 1 кг рения перерабатывают 2000 тонн руды; месторождение этого металла обнаружено на острове Итуруп, который в числе прочих японцы оспаривают у России;
- калифорний – дороговизна этого радиоактивного элемента не имеет равных: за 1 г вещества придется выложить 27 миллионов долларов;
- вольфрам – рекордсмен по тугоплавкости: температуру для его плавления приходится поднимать выше 3400 градусов;
- золото – чемпион по ковкости: из 1 г золота ювелир вытянет проволоку длиной свыше 2 км;
- азот – атмосфера на 78 % состоит из азота, при этом он не используется никем из живых организмов, кроме азотфиксирующих бактерий;
- водород – Вселенная принадлежит водороду, который составляет в ней 90 %.
Как разбитая колба послужила самолетостроению
Французский художник и химик Эдуард Бенедиктус в 1903 году стал автором изобретения, спасшего не одну жизнь. В тот день он проводил опыты с нитроцеллюлозой и неосторожно выронил колбу. Стекло растрескалось, но склянка сохранила форму. Однако Бенедиктус был настолько раздосадован, что просто выбросил ее.
Вечером ученый стал свидетелем автомобильной аварии. Лобовое стекло, разлетевшееся острыми осколками, изуродовало лицо выжившего водителя. И перед глазами химика всплыла разбитая колба… Она была бережно извлечена из мусорного ведра и послужила науке. Так человечество получило триплекс – материал для стекол транспортных средств, стеклянных навесов и дверей.
Сварливая жена и рождение резины
Американский химик Чарльз Гудиер много лет безрезультатно пытался улучшить свойства каучука, смешивая его с различными веществами. Супруга ученого была недовольна его работой, поскольку денег изобретательство не приносило, а вонь в доме стояла приличная. Гудиер нервничал, стал скрывать от жены свои опыты, но надежды не терял.
Супруга ученого была недовольна его работой, поскольку денег изобретательство не приносило, а вонь в доме стояла приличная. Гудиер нервничал, стал скрывать от жены свои опыты, но надежды не терял.
Однажды он смешал каучук с серой, но из этой затеи опять ничего не вышло. Заслышав шаги миссис Гудиер, ученый бросил смесь на горячие угли печки, пытаясь сделать вид, что ничем таким он не занимался. Выслушав очередную нотацию жены и дождавшись ее ухода, изобретатель достал из печки именно то, что хотел увидеть много лет, – вулканизированную резину.
Искусство давать имена
Крохотный шведский городок Иттербю четыре раза упоминается в периодической системе. От этого топонима образованы названия элементов иттербия, иттрия, эрбия и тербия. Все они найдены в составе необычайно тяжелого минерала, который добывают в окрестностях городка.
Горняки из Норвегии до сих пор поклоняются горному духу Кобольду, во власти которого завалить шахты или отпустить людей живыми. При переплавке серебряных руд в прежние времена часто случались отравления, которые тоже приписывали вредности горного духа. Металл, добываемый из этой руды, в его честь назвали кобальтом, хотя в отравлениях был виноват оксид мышьяка.
Звучное имя «Амкар» пермского футбольного клуба вводит в заблуждение всех, кто не знаком с историей его создания. А ведь это имя, словно шарада, состоит из первых слогов, входящих в слова «аммиак» и «карбамид». Объясняется это просто: компания, создавшая клуб, выпускает минеральные удобрения.
Маленькая добавка – совсем другие свойства
Немецкая мортира «Большая Берта», созданная для разрушения фортов и крепостей, обладала серьезным недостатком – легендарная крупповская сталь ствола деформировалась от перегрева. Для исправления ситуации требовалось легировать сталь молибденом. Наиболее крупное месторождение на тот момент было открыто в американском штате Колорадо. Хитростью, уговорами и даже, как поговаривают, чуть ли не рейдерским захватом путь молибдена был проложен в Германию.
Немецкая мортира «Большая Берта»
Конструктор «Лего» – одна из любимейших детских игрушек. И чем мельче его детальки, тем интереснее с ним возиться. Однако существует опасность, что, заигравшись, ребенок проглотит элемент конструктора. Создатели игры подумали об этом и добавили к пластмассе безвредный сульфат бария. Теперь проглоченную деталь обнаруживают при помощи рентгена.
Химики шутят
Большинству ученых так надоели дилетантские ужастики о ГМО, что в ответ химики стали рассылать призывы о полном и бесповоротном запрете монооксида дигидрогена. Они пишут, что это опасное соединение приводит к коррозии металлов и порче большинства прочих материалов, входит в состав кислотных дождей и сбросов с предприятий. Человек, в чей организм попадает монооксид дигидрогена, неминуемо умирает, иногда даже спустя минуту.
В 2007 году дело дошло до подлинного курьеза: получив от избирателей гневное описание жуткого яда, который повсеместно добавляют в пищу, один новозеландский депутат обратился с запросом к правительству, требуя полного запрета подобной «химии». А ведь речь шла о воде.
Химия – это наша жизнь. Мы сами состоим из «монооксида дигидрогена» и десятков тысяч других веществ, которые постоянно друг с другом взаимодействуют, рождая новые соединения. И сколько еще чудесных открытий и изобретений ждет увлеченных людей в прожженных халатах – узнаем, когда начнем использовать их.
Поделитесь статьей с друзьями:
Похожие статьи
Интересные факты в химии — презентация онлайн
1. ИНТЕРЕСНЫЕ ФАКТЫ: ХИМИЯ
Мальгина Екатерина, Вологодская ГМХА, 26.12.20182. В каком случае этиловый спирт может служить противоядием?
Метиловый спирт по вкусу и запаху неотличим отэтилового, однако его действие на организм гораздо
опаснее. Даже небольшое количество метанола может
привести к слепоте, а доза от 30 мл — к смерти.
 Этим
Этимобъясняются частые случаи отравления метиловым
спиртом либо по незнанию, либо в случае употребления
поддельного алкоголя. Интересно то, что в случае
такого отравления противоядием является обычный, то
есть этиловый спирт. Это связано с тем, что процессы
связывания обоих спиртов в организме происходят с
участием одного фермента алкогольдегидрогеназы, но
так как реакция с этанолом происходит быстрее,
вредных продуктов расщепления метанола в крови в
итоге оказывается гораздо меньше.
3. Почему фуллерены не были названы в честь футбольного мяча?
В 1985 году группа американских ианглийских исследователей открыли
молекулярные соединения из
углерода, сильно напоминающие
своей формой футбольный мяч. В
честь него и хотели назвать открытие,
однако учёные не договорились, какой
термин использовать — football или
soccer (как зовут футбол в США). В
итоге соединения назвали
фуллеренами в честь архитектора
Фуллера, который придумал
геодезический купол, составленный из
тетраэдров.
4. Какая деталь автомобиля была изобретена случайно?
Небьющееся стекло былоизобретено случайно. В 1903
году французский химик Эдуард
Бенедиктус нечаянно уронил
колбу, заполненную
нитроцеллюлозой. Стекло
треснуло, но не разлетелось на
мелкие кусочки. Поняв, в чём
дело, Бенедиктус изготовил
первые лобовые стёкла
современного типа, чтобы
уменьшить количество жертв
автомобильных аварий.
5. Какой футбольный клуб назван в честь двух химических веществ, одно из которых — яд?
Футбольный клуб «Амкар» изПерми получил название от
сокращения двух химических
веществ — аммиака и
карбамида, так как они были
главной продукцией ОАО
«Минеральные удобрения»,
создавшей клуб.
6. Неполадки в какой бытовой системе объясняют множество феноменов из разряда «дом с привидениями»?
Множество феноменов из разряда «дом спривидениями» объясняется всегонавсего плохо работающей системой
отопления, вызывающей у жителей
отравление угарным газом в малой
концентрации.
 В число симптомов такого
В число симптомов такогоотравления, помимо головных болей и
чувства усталости, входят также
зрительные и слуховые галлюцинации.
7. Кто сыграл ключевую роль в популяризации шампанского?
Изобретателем шампанского многиесчитают французского монаха Пьера Дом
Периньона, однако это далеко от истины.
Он разработал много техник, которые и
сейчас применяются производителями
шампанского в процессе изготовления
начального вина, однако пузырьки в вине
считал признаком брака. А ключевую роль
в популяризации пузырящегося вина
сыграли англичане. Они импортировали
вина из провинции Шампань, а затем
переливали их из бочек в бутылки с
пробкой из пробкового дерева (чего
французы тогда не знали). После
возобновления процесса ферментации в
бутылках начинал образовываться
углекислый газ, и вино в открытых
бутылках пузырилось, что очень
понравилось англичанам.
8. Какие существа виновны в цвете Кровавого водопада в Антарктиде?
В Антарктиде из ледника Тейлоравременами выходит Кровавый водопад.
Вода в нём содержит двухвалентное
железо, которое, соединяясь с
атмосферным воздухом, окисляется и
образует ржавчину. Это и придаёт водопаду
кроваво-рыжий цвет. Однако двухвалентное
железо в воде возникает не просто так —
его производят бактерии, живущие в
изолированном от внешнего мира водоёме
глубоко подо льдом. Эти бактерии сумели
организовать жизненный цикл при полном
отсутствии солнечного света и кислорода.
Они перерабатывают остатки органики, а
«дышат» трёхвалентным железом из
окружающих пород.
9. Какой химический элемент был получен как побочный эффект от попытки выделить золото из мочи?
В 1669 году немецкий алхимик БрандХенниг в поисках философского камня
решил попробовать синтезировать
золото из человеческой мочи. В
процессе её выпаривания,
дистилляции и прокаливания он
получил белый порошок, светящийся
в темноте.
 Хенниг принял его за
Хенниг принял его за«первичную материю» золота и назвал
«светоносец» (что по-гречески
произносится как «фосфор»). Когда
дальнейшие манипуляции с этой
материей так и не привели к
получению драгоценного металла, он
начал продавать новое вещество ещё
дороже, чем само золото.
10. В каких отраслях промышленности используется вещество, ответственное за запах фекалий?
За характерный запах фекалийответственно органическое
соединение скатол. Однако в
небольших дозах скатол
обладает приятным цветочным
запахом. Его применяют для
производства парфюмерии и
сигарет, в пищевой
промышленности.
11. Почему платина сначала была дешевле серебра, а теперь гораздо дороже?
Платина в переводе с испанскогобуквально означает «серебришко».
Объясняется такое
пренебрежительное название, данное
этому металлу конкистадорами,
исключительной тугоплавкостью
платины, которая не поддавалась
переплавке, долгое время не
находила применения и ценилась
вдвое ниже, чем серебро. Сейчас на
мировых биржах платина дороже
серебра примерно в 100 раз.
Химия: факты (Science Trek: Idaho Public Television)
См. 10 основных вопросов
Дело
Все, что имеет вес или массу и занимает место, называется материей. Материя — это «вещество» в нашем мире. Протяните руку и коснитесь ближайшего предмета мебели. Это вопрос. То же самое и с одеждой, которую вы носите, с волосами на голове и с воздухом, которым вы дышите. Когда мы изучаем материю, мы изучаем химию. Материю можно разбить на мельчайшие части, чтобы узнать, что делает ее такой, какая она есть.Давайте посмотрим…
Атомов
Вся материя состоит из маленьких частиц, известных как атомы. Они составляют воздух, воду, наши тела, пищу, деревья, автомобили и даже компьютер, с которого вы просматриваете этот веб-сайт. Атомы настолько малы, что их не видно. Но в точке в конце этого предложения могло быть более 4 миллиардов миллиардов атомов. Атомы состоят из трех субатомных частиц, известных как протоны, нейтроны и электроны. Протоны и нейтроны собираются вместе, образуя ядро.Электроны вращаются вокруг ядра.
Атомы состоят из трех субатомных частиц, известных как протоны, нейтроны и электроны. Протоны и нейтроны собираются вместе, образуя ядро.Электроны вращаются вокруг ядра.
Каждая из этих субатомных частей может быть разбита еще немного. Ученые продолжают узнавать об атомах все больше и больше. Это может быть очень сложно, поэтому пока давайте придерживаться перечисленных выше условий.
Есть разные типы атомов, и атомы объединяются особым образом, чтобы образовать всю материю в нашем мире. Вот почему мех кошки так отличается от стального бампера на машине. Но оба они по-прежнему состоят из атомов. Атомы различаются количеством протонов и электронов, которые они содержат.
Физические свойства
Атомы объекта помогают придать ему физические свойства, которые мы используем для описания того, что мы видим. Когда мы говорим о том, сколько весит объект, какого он цвета, насколько он большой, на что он похож и какова его температура, мы говорим о физических свойствах объекта.
Химические свойства
Атомы также создают химические свойства объекта. Но это то, что мы можем понять только на самом маленьком уровне — думая, как сам атом.Химические свойства определяются способностью объекта изменяться при правильных условиях. Например, способность объекта воспламеняться — это химическое свойство.
Физические изменения
Материя может меняться по-разному. Физические изменения происходят, когда мы разрезаем лист бумаги на два куска. Это все еще бумага, только другого размера. Мы можем изменить температуру стакана воды, смешать краски двух разных цветов или разрезать морковь на кусочки. Несмотря на все эти различные изменения, это все еще вода, краска или морковь.
Физические изменения влияют только на то, как это выглядит или ощущается. Физические изменения не влияют на химический состав объекта.
Химические изменения
Химические изменения происходят, когда мы вносим изменения в материю на химическом уровне. Наиболее очевидные доказательства того, что произошли химические изменения, обнаруживаются при выделении тепла, света, пузырьков, шипения, пламени или газов. Часто происходит необратимое изменение его цвета.
Наиболее очевидные доказательства того, что произошли химические изменения, обнаруживаются при выделении тепла, света, пузырьков, шипения, пламени или газов. Часто происходит необратимое изменение его цвета.
Когда вы, например, чиркаете спичкой, раздается шипение, тепло и сильный запах из-за выделения газов.Это признаки того, что произошло химическое изменение. Вы действительно создали новое химическое вещество.
Иногда химические изменения происходят в результате медленной реакции — например, ржавчины. Ржавчина возникает в течение длительного периода времени, когда железо подвергается воздействию кислорода. Но ржавчина — новое химическое вещество. Это не железо и не кислород; это ржавчина.
Элементы
Насколько известно ученым, все во Вселенной состоит из немногим более 100 элементов. Элементы составляют основные ингредиенты, которые мы называем материей.Элемент состоит только из одного типа атомов. Какая-то материя состоит всего из одного элемента. Например, кислород является одним из основных элементов и состоит только из атомов кислорода.
Периодическая таблица элементов используется для организации элементов для облегчения идентификации. В Периодической таблице элементы группируются по атомному весу. Большинство элементов естественным образом встречаются во Вселенной, но некоторые из них были созданы учеными в лабораториях. Эта интерактивная периодическая таблица от Национальной лаборатории Айдахо поможет вам узнать больше.
Соединения
Хотя некоторые вещи в нашем мире состоят из одного элемента, например, кислорода, углерода или золота, многие из них представляют собой комбинацию двух или более элементов. Вода состоит из двух химически связанных элементов. Когда элементы химически связаны друг с другом, они известны как соединение. В воде 2 атома водорода и 1 атом кислорода. Мы называем это h30. Состав написан таким образом, чтобы мы могли идентифицировать химический рецепт. Мы называем это формулой.
h30 показывает нам, что с каждым атомом кислорода связаны 2 атома водорода.
Состояния Материи
Материя может существовать на Земле в твердой, жидкой или газовой форме. Вода твердая, как лед, жидкость, когда мы ее пьем, и газ, когда это пар. Наука обнаружила, что существуют дополнительные состояния материи. Но твердые, жидкие и газообразные формы — самые простые и очевидные в нашем повседневном мире.
Посетите сайт Science Trek «Состояния материи», чтобы узнать больше о различных состояниях материи.
Случайные химикаты
Знаете ли вы, что клей, использованный в блокнотах марки Post-it, был случайно? Так же было и средство защиты ткани, известное как Scotchgard. Этот продукт случайно пролился на обувь лаборанта, и когда было обнаружено, что грязь не прилипает к этому месту, родился новый продукт. Оба химиката были изобретены в лаборатории 3М. Но они изначально не предназначались для приложения, которое в итоге создали. Многие продукты, которые мы используем в повседневной жизни, являются результатом химии.Некоторые удивительные были результатом счастливых случайностей.
Кислоты и основания
Некоторые химические вещества могут быть очень сильными. Из-за этого, ХИМИЧЕСКИХ ВЕЩЕСТВ НИКОГДА НЕ ДОЛЖНЫ ПРОГНОЗИРОВАТЬСЯ БЕЗ НАЗНАЧЕНИЯ ВЗРОСЛЫХ.
Кислоты кислые и могут быть достаточно сильными, чтобы разъедать металлы. Некоторые кислоты, такие как лимонный сок или уксус, мы можем есть. Другие кислоты используются в батареях, чтобы заставить их работать. Эти типы кислот ОПАСНЫ, и обращаться с ними должны только люди, специально обученные для работы с ними.
Основания противоположны кислотам и имеют горький вкус. Мыло — это обычная основа, которую можно найти в доме. Если вы случайно попали в рот шампунь во время мытья головы, вы испытали его горький вкус. Многие основания очень вредны, потому что могут разрушать клетки.
Напоминание: ХИМИЧЕСКИЕ ВЕЩЕСТВА НИКОГДА НЕ ДОЛЖНЫ ПРОГНОЗИРОВАТЬСЯ БЕЗ НАПРАВЛЕНИЯ Взрослых.
Тест PH
Чтобы определить, является ли химическое вещество кислотой или основанием, химики могут протестировать его с помощью специальной бумаги.Эта бумага известна как лакмусовая бумага, и она меняет цвет под воздействием химикатов. Это называется проверкой PH. Сравнивая цвет измененной бумаги, химики могут сказать, является ли вещество кислотой или основанием.
Проблемы с животом
Иногда люди используют антациды, чтобы избавиться от расстройства желудка. Антацид — это основание, которое при растворении в желудочной кислоте нейтрализует эту кислоту и лишает ее кислотных свойств. Кислота больше не беспокоит желудок человека, и он чувствует себя лучше.Химия работает в нашей жизни.
Чтобы узнать больше
Изучение материи и ее изменений — химическая наука. Есть еще очень много того, что нужно изучить и узнать о химии. Ученые узнают о химии все больше и больше с каждым днем. Химия позволяет ученым создавать лекарства, чтобы нам было хорошо. Химия отвечает за превращение использованных молочных кувшинов в ковер для дома и школы. Химия позволяет ученым определять, какие вещества составляют планеты и звезды, даже на расстоянии в миллионы миль.Химические изменения происходят даже внутри нашего тела, что способствует пищеварению и другим удивительным процессам. Продолжайте изучать химию, и вы можете стать будущим ученым, который найдет способ приводить в движение автомобили, используя воздух, которым мы дышим.
фактов о химии для детей
Химия — это наука о химических элементах и соединениях .Химия — это раздел науки, изучающий химические элементы и соединения, а также то, как эти вещи работают вместе.Это изучение материалов (вещей), из которых состоят наши тела и все в мире вокруг нас.
История
До 1600 года люди изучали вещества, чтобы выяснить, как превращать свинец в золото, но никому этого не удавалось. Это называлось алхимией. Однако алхимики (люди, которые занимались алхимией) действительно открыли некоторые полезные вещи. Серная кислота и азотная кислота были двумя веществами, которые они открыли. Было известно лишь несколько элементов. Некоторые из них — это ртуть, серебро, золото и углерод.
Химия возникла как настоящая наука в 1600-х годах. Именно тогда химики открыли простейшие вещества, из которых состоят все другие вещества. Эти простые вещества называются элементами. Они узнали, что золото и свинец — два разных элемента, поэтому вы не можете превратить один в другой с помощью химической реакции. Первым элементом, обнаруженным после 1600 года, был фосфор, странное белое светящееся твердое вещество.
Элементов открывались все быстрее и быстрее.Люди разделили воздух на множество частей и изолировали от него благородные газы. Они также обрабатывали специальные минералы из шахты в Швеции, чтобы получить редкоземельные металлы. Также была обнаружена радиоактивность. Сегодня химики открыли 118 различных элементов. Некоторые из них очень распространены, например кислород. Многие из них очень редкие и дорогие, как платина. Некоторые из них нельзя найти на Земле, и их можно получить только в лабораториях, например, резерфордий.
Начиная с 1920-х годов, более глубокое понимание физики изменило представления химиков о химических реакциях.С меньшими и более быстрыми компьютерами химики создали более совершенные инструменты для анализа веществ. Эти инструменты были отправлены для изучения химических веществ на Марсе. Полиция также использует эти инструменты для изучения улик с мест преступлений.
Виды химии
Есть несколько видов химии. Аналитическая химия изучает, какие химические вещества находятся в вещах. Например, посмотреть, сколько мышьяка содержится в пище. Органическая химия изучает вещи, в которых есть углерод. Например, изготовление ацетилена.Неорганическая химия изучает вещи, в которых нет углерода. Один из примеров — создание интегральной схемы.
Большой областью химии является химия полимеров. Это смотрит на пластик. Один из примеров — изготовление нейлона. Поскольку пластмассы состоят из углерода, химия полимеров является частью органической химии. Другая область — биохимия. Это смотрит на химию живых существ. Примером может служить то, как мышьяк отравляет людей. Биохимия также является частью органической химии. Есть много других небольших разделов химии.
Понятия химии
Основные понятия
Основная единица элемента называется атомом. Атом — это наименьший строительный блок, на который вы можете разрезать элемент, не разрушая элемент (превращаясь в более легкий элемент, например, в результате ядерного деления или радиоактивного распада). Химическое соединение — это вещество, состоящее из двух или более элементов. В соединении два или более атома соединяются вместе, образуя молекулу. Мельчайшая пылинка или капля жидкости, которую можно увидеть, состоит из многих миллионов или миллиардов этих молекул.Смеси — это вещества, в которых химические вещества смешиваются, но не вступают в реакцию. Примером может быть смешивание песка и соли. Это можно отменить снова, чтобы получить соль и песок отдельно. Химические соединения изменяются химической реакцией. Примером может служить нагревание бикарбоната натрия, обычной пищевой соды. Он будет производить воду, углекислый газ и карбонат натрия. Эту реакцию нельзя отменить.
Моль
Моль — это очень большое количество атомов (602 214 150 000 000 000 000 000 атомов). Атомная масса элемента может использоваться, чтобы увидеть, какая часть элемента составляет моль.Например, атомная масса меди около 63,55. Это означает, что около 63,55 грамма металлической меди содержит моль атомов. Атомная масса хлора около 35,45. Это означает, что в 35,45 граммах хлора содержится моль атомов.
Молей также можно использовать для определения количества молекул в химических соединениях. Примером может служить хлорид меди (II). CuCl 2 — его химическая формула. Есть один атом меди (63,55) и два атома хлора (35,45 · 2 = 70,90). Сложите все молярные массы элементов вместе, чтобы получить молярную массу химического соединения (63.55 + 70,90 = 134,45). Это означает, что в 134,45 граммах хлорида меди (II) содержится один моль молекул хлорида меди (II). Эта концепция используется для расчета, сколько химикатов необходимо для химической реакции, если не должно оставаться никаких реагентов (химикатов, которые вступают в реакцию). Если используется слишком много реагента, в химической реакции останутся некоторые реагенты.
Кислоты и основания
Кислоты и основания — обычные химические вещества. Кислоты выделяют ионы H + в воде, а основания выделяют ионы OH — в воде.Кислоты могут реагировать с основаниями. Ион H + отделяется от кислоты основанием. Это делает воду H 2 O. Соль также образуется, когда кислота и основание взаимодействуют вместе. Примером может быть взаимодействие соляной кислоты (HCl) и гидроксида натрия (NaOH). Соляная кислота выделяет в воду ионы H + и Cl — . Основание выделяет ионы Na + и OH — . H + и OH — реагируют с образованием воды. Остался раствор хлорида натрия (NaCl).Хлорид натрия — это соль.
Полезность
Химия очень полезна в повседневной жизни и составляет основу многих отраслей науки. Большинство предметов делают химики (люди, занимающиеся химией). Химики постоянно работают над поиском новых и полезных веществ. Химики создают новые лекарства и материалы, такие как краски, которые мы используем каждый день.
Безопасность
Этот химик одет в защитные очки, лабораторный халат и перчатки. Он смотрит на камень с луны.Многие химические вещества безвредны, но есть и опасные.Например, хлорид ртути (II) очень токсичен. Хроматы могут вызывать рак. Хлорид олова (II) легко загрязняет воду. Соляная кислота может вызвать сильные ожоги. Некоторые химические вещества, например водород, могут взорваться или загореться. Чтобы оставаться в безопасности, химики экспериментируют с химическими веществами в химической лаборатории. Они используют специальное оборудование и одежду для проведения реакций и удержания содержащихся химикатов. Химические вещества, используемые в лекарствах и в таких вещах, как отбеливатель, были протестированы, чтобы убедиться, что они безопасны при правильном использовании.
Связанные страницы
Картинки для детей
Джабир ибн Хайян (Гебер), персидский алхимик, экспериментальные исследования которого заложили основы химии.
Антуан-Лоран де Лавуазье считается «отцом современной химии».
В своей периодической таблице Дмитрий Менделеев предсказал существование 7 новых элементов и поместил все 60 элементов, известных в то время, на их правильные места.
Схема атома на основе модели Резерфорда
Изображение молекулы кофеина (C8h20N4O2) в виде шарика и палки.
Анимация процесса ионной связи между натрием (Na) и хлором (Cl) с образованием хлорида натрия или поваренной соли. Ионная связь заключается в том, что один атом забирает валентные электроны у другого (в отличие от совместного использования, которое происходит при ковалентной связи)
В ходе химических реакций связи между атомами разрываются и образуются, в результате чего образуются различные вещества с разными свойствами. В доменной печи оксид железа, соединение, реагирует с оксидом углерода с образованием железа, одного из химических элементов, и диоксида углерода.
Структура кристаллической решетки хлорида калия (KCl), соли, которая образуется из-за притяжения катионов K + и анионов Cl-. Обратите внимание на то, что общий заряд ионного соединения равен нулю.
химический элемент | Определение, происхождение, распространение и факты
Химический элемент , также называемый элементом , любое вещество, которое не может быть разложено на более простые вещества с помощью обычных химических процессов.Элементы — это фундаментальные материалы, из которых состоит вся материя.
Британская викторина
Типы химических реакций
Можете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этой викторины!
В этой статье рассматривается происхождение элементов и их распространенность во Вселенной.Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Редакция Британской энциклопедииОбщие наблюдения
В настоящее время известно 118 химических элементов.Около 20 процентов из них не существуют в природе (или присутствуют только в следовых количествах) и известны только потому, что были синтетически получены в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть благородных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся примерно при температуре выше комнатной температуры), а остальное — твердые частицы. Элементы могут объединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями.Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, совершенно отличные от характеристик составляющих его элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород.Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может химически разлагаться на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Историческое развитие концепции элемента
Современная концепция элемента однозначна, поскольку она зависит от использования химических и физических процессов как средства отделения элементов от соединений и смесей. Однако существование фундаментальных веществ, из которых состоит вся материя, было основой многих теоретических рассуждений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного принципа — элемента.Фалес считал, что этот элемент — вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, выразил иную веру — что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель согласился и подчеркнул, что эти четыре элемента являются носителями фундаментальных свойств: сухость и тепло связаны с огнем, тепло и влага связаны с воздухом, влага и холод — с водой, а холод и сухость — с землей. В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасВо второй половине средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие концепции состава материи стали менее удовлетворительными.Были введены дополнительные элементарные качества, чтобы приспособиться к недавно обнаруженным химическим превращениям. Таким образом, сера стала олицетворять горючесть, ртуть — летучесть или текучесть, а соль — стойкость в огне (или негорючесть). Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций.
Важное различие между смесью и химическим соединением в конце концов было понято, и в 1661 году английский химик Роберт Бойль осознал фундаментальную природу химического элемента.Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут объединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и соотносил их с соединениями, которые они образуют, современными методами.
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного исследования реакций разложения и рекомбинации.Поскольку он не мог проводить эксперименты по разложению определенных веществ или формированию их из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, глинозем и кремнезем, которые, как теперь известно, являются очень стабильными соединениями. На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
Семь веществ, признанных сегодня элементами, — золото, серебро, медь, железо, свинец, олово и ртуть — были известны древним, поскольку встречаются в природе в относительно чистой форме.Они упоминаются в Библии и в раннем индуистском медицинском трактате Чарака-самхита . Шестнадцать других элементов были открыты во второй половине 18 века, когда методы отделения элементов от их соединений стали более понятными. Еще восемьдесят два последовали после внедрения количественных аналитических методов.
Информационный бюллетень по химии
Что такое химия?
Кредит: стоковое изображение.
Химия — это изучение «вещей» или «материи».«Он фокусируется на атомах и молекулах, из которых состоят наши тела, мир вокруг нас и Вселенная.
Химики стремятся понять основные свойства природных и искусственных материалов, а именно плотность, кислотность, форму, цвет, текстуру, реакционную способность, уровень энергии и многое другое. Конечная цель химика — предсказать и объяснить — а в некоторых случаях и контролировать — как вещества будут изменяться, когда они вступают в реакцию с другими веществами или с энергией.
Некоторые химики специализируются на изучении определенных типов химических реакций или определенных типов молекул.Другие стремятся создавать новые или улучшенные продукты, такие как лекарства, ароматизаторы, ароматизаторы, пигменты, ткани или пластмассы. Третьи изобретают более эффективные способы управления химическими реакциями для использования в исследованиях, промышленности, сельском хозяйстве или коммерческих процессах.
Химики часто описывают себя, используя определенные термины, например, химик-органик, биохимик, химик-ядерщик, физико-химик или химик-материаловед. Для простоты мы будем использовать термин химик для обозначения всех таких специальностей.
Почему важно изучение химии?
Современная химия занимается разработкой более чистых и эффективных химических реакций.Химики недавно разработали новый метод производства молекул dNTP, строительных блоков ДНК, которые ученые используют при усилении генетического материала для фундаментальных исследований, судебной медицины, идентификации инфекционных заболеваний и множества других целей. Обычное производство dNTP включает в себя много этапов и больших объемов опасных химикатов. Разработав способ производства dNTP в одной емкости всего за три этапа, на одном производственном предприятии dNTP было устранено 1,5 миллиона фунтов опасных отходов в год.Кредит: стоковое изображение.
Будь то в организме, в окружающей среде или на заводе, все химические реакции делают одно и то же: они превращают исходные материалы или реагенты в продукты. Лучшее понимание химических реакций может помочь нам решить некоторые из наиболее серьезных проблем, с которыми сегодня сталкивается наш мир, включая болезни, загрязнение, голод и глобальное потепление. Сейчас химиков:
- Изучение химических реакций, протекающих в живых организмах, чтобы помочь нам понять болезни и найти способы борьбы с ними.
- Анализ и создание новых версий веществ, вырабатываемых микробами, водорослями, растениями и животными, для создания новых антибиотиков, обезболивающих, противоопухолевых препаратов и других средств лечения.
- Разработка более чистых и эффективных химических реакций для замены технологий, которые создают загрязняющие вещества, производят токсичные побочные продукты или требуют ограниченных природных ресурсов.
- Разработка экологически чистых пестицидов, гербицидов и удобрений, чтобы сделать продукты питания более безопасными и доступными для тех, кто в них нуждается.
- Изучение парниковых газов и реакций, которые их вызывают, в попытке замедлить глобальное потепление и смягчить его последствия.
Какие химические реакции происходят в организме?
Химики, поддерживаемые Национальным институтом здоровья, в основном занимаются химическими реакциями, которые происходят у людей, а также в бактериях, вирусах, грибах и других организмах, влияющих на наше здоровье, и это называется биологической химией. Вот несколько примеров:
- Молекулы, известные как гормоны, запускают химические реакции, которые помогают контролировать рост, иммунную функцию, размножение и многие другие основные жизненные процессы.
- Наши тела производят белки, используя химические реакции для активации определенных генов.
- После того, как мы едим, химические реакции (в том числе некоторые из них осуществляются полезными кишечными бактериями) превращают нашу пищу в основные строительные блоки, такие как аминокислоты, сахар и жирные молекулы, которые поддерживают работу нашего организма.
- Ферменты в печени химически модифицируют лекарства, влияя на то, как лекарства действуют в нашем организме.
- Наши клетки используют химически срабатывающие ворота на своей поверхности, чтобы контролировать, какие атомы и молекулы входят и выходят.
Какие инструменты используют химики?
Химики постоянно разрабатывают инструменты, позволяющие соединять молекулы вместе с большей легкостью и скоростью и с меньшим количеством токсичных ингредиентов и побочных продуктов. Они также создают инструменты визуализации, такие как флуоресцентные зонды, которые позволяют им освещать ДНК, белки и другие интересующие цели. Многие инструменты, разработанные химиками, позже используются учеными в других областях. Например, химики сыграли важную роль в превращении зеленых и красных флуоресцентных белков в исследовательские инструменты, которые теперь регулярно используются биологами для визуализации основных жизненных процессов.Вот несколько примеров из множества инструментов химии:
- Химики используют металлический палладий в качестве катализатора для соединения атомов углерода для создания сложных лечебных натуральных продуктов, которые имеют потенциальное терапевтическое применение, например, токсин, содержащийся в ядовитых лягушках-дротиках.
- Они используют соединение титана, чтобы направлять химические реакции в сторону медицинской активной формы продуктов. Большинство малых молекул имеют как «правую», так и «левую» формы. Иногда одна из этих форм терапевтически активна, а другая неэффективна или даже токсична.
- Химики используют ферменты, как природные, так и искусственно созданные, для ускорения химических реакций. Недавно они разработали фермент, который устраняет несколько этапов создания ведущего статинового препарата для лечения высокого уровня холестерина.
Как химия участвует в разработке лекарств?
Химики используют светоизлучающие молекулы для освещения ДНК, белков и других интересующих объектов. На этом изображении сперматид плодовой мушки, предшественников зрелых сперматозоидов, красные флуоресцентные белки маркируют ядра, а зеленые флуоресцентные белки маркируют белок, строящий клеточный скелет, называемый тубулином.
Предоставлено: Лакрамиоара Фабиан, лаборатория Брилла, Больница для больных детей.
От открытия новых молекул с терапевтическим потенциалом до разработки новых лекарств и улучшения существующих — химики играют неотъемлемую роль в разработке лекарств. Они работают, чтобы оптимизировать химические свойства лекарства, чтобы оно эффективно усваивалось организмом, распределялось в нужном месте и метаболизировалось таким образом, чтобы лечить состояние, не вызывая токсичности. Вот некоторые из конкретных способов, которыми химики могут внести свой вклад в разработку лекарств:
- Химики, обычно с помощью компьютеров, могут создавать и просеивать огромные коллекции — или «библиотеки» — молекул, чтобы идентифицировать молекулы, способные лечить симптом или бороться с рассматриваемым заболеванием.
- Ученые-фармацевты могут оценить способность молекулы стать лекарством, анализируя ее химический состав, стабильность и растворимость в воде или жидкостях организма.
- Химики могут изменять существующие лекарства, чтобы они были более безопасными, более эффективными или могли лучше бороться с лекарственной устойчивостью.
Как развивается химия?
Область химии намного шире, чем биомедицинские приложения, которые мы здесь рассматриваем. Сюда входят такие проекты, как создание новых косметических продуктов или промышленных материалов, работа со следователями по уголовным делам для анализа улик, нейтрализация опасных отходов и многое другое.Но вот некоторые из последних достижений биомедицины:
- Новые методы визуализации позволяют получать все более точные изображения химических структур и связей внутри них.
- Технологические инновации предоставляют новые способы обнаружения химических соединений в крови, продуктах питания, лекарствах и окружающей среде.
- Новые химические вещества позволяют исследователям изучать отдельные молекулы и химические реакции между ними в живых организмах, не вмешиваясь в естественные биохимические процессы.
- Исследователи надеются использовать методы из новой дисциплины, называемой биоортогональной химией, для производства лекарств внутри тела.
Подробнее:
Химия здоровья
Познакомьтесь с химиком Галерея
Пять неприятных вещей, которые также полезны для вас из Inside Life Science
Greening of Chemistry from Inside Life Science
Сфера деятельности: Сделать химию экологичнее
Металлы: болезнь и здоровье из Inside Life Science
Почему сахар может вас удивить из Inside Life Science
Землетрясение, вызвавшее холеру из Inside Life Science
Nature: The Master Производитель лекарств из Inside Life Science
The Chemistry of Health Crossword
NIGMS является частью Национального института здравоохранения, который поддерживает фундаментальные исследования, направленные на улучшение нашего понимания биологических процессов и закладывает основу для достижений в диагностике, лечении и профилактике заболеваний.Для получения дополнительной информации об исследовательских и учебных программах Института см. http://www.nigms.nih.gov .
Контент создан Август 2015 г.
Факты и темы для обсуждения химии
Вы можете помочь людям в вашем сообществе оценить роль химии в крупных общественных обсуждениях, таких как изменение климата, устойчивость и федеральные исследования, демонстрируя и объясняя многочисленные роли химии и химиков в улучшении жизни людей.
Темы для обсуждения — один из эффективных способов систематизировать свои мысли и упростить запоминание сообщения. Это короткие краткие заявления, которые можно легко включить в рекламные продукты и другие материалы. Думайте о них как о «байтах звука» для телевизионных новостей или «приманке» к газетной статье. Чтобы иметь наилучшие шансы на улучшение имиджа химиков и химиков, абсолютно необходимо, чтобы все мы говорили единым голосом и общей целью.
Это примеры и тезисы о пользе химии для общества, которые помогут вам общаться на актуальные темы.Используйте эти сообщения, чтобы сделать важные и долговременные замечания о химии.
- Химики вносят важный вклад в обеспечение устойчивости — химики разрабатывают новые типы материалов, чтобы предотвратить истощение ценных природных ресурсов, а химики работают над очисткой ручьев и воздуха.
- Поиск способов сделать альтернативную экологически чистую энергию реальностью может привести к развитию новых отраслей солнечной, ветровой или биотопливной энергетики в вашем регионе.
- Новые исследования проводятся в университетах и исследовательских учреждениях вашего региона.Федеральное финансирование поддерживает многие области исследований, которые способствуют созданию новых продуктов, лекарств и знаний, а также поддерживают рабочие места в США
Список способов, которыми химики помогают обществу, практически неограничен! Ниже приведены некоторые примеры сообщений ACS:
- Химия повсюду и вносит свой вклад в повседневную жизнь каждого; он изменил и продолжает изменять нашу жизнь.
- Химия и химики внедряют инновации, чтобы находить решения проблем и улучшать нашу жизнь (например,грамм. зеленая химия)
- Химия важна для экономического здоровья нашей нации.
- Жизненно важно, чтобы следующее поколение понимало, что химия повсюду; является преобразующей силой, улучшающей жизнь и наше общество; и это важная профессия, потому что карьера в области химии открывает возможности изменить мир.
- Точки разговора по адвокации об устойчивой федеральной поддержке исследований (PDF)
Для получения дополнительных примеров и советов о том, как развивать сильные темы для обсуждения и сообщения, посетите ACS PR Guidebook.
Дополнительные сообщения ACS и вопросы защиты, которые помогут вам
25 странных фактов о химии — Либеральная Америка
На этой неделе проводится Национальная неделя химии, и в честь наших любимых ботаников-химиков мы предлагаем вам 25 странных фактов о химии, о которых вы, вероятно, не знали.
- Сегодня День кротов. Каждый год 23 октября с 6:02 до 18:02 студенты-химики и химики празднуют День Крота в честь числа Авогадро, количества атомов углерода в 12 граммах углерода.
- В организме среднего взрослого человека содержится около 1/2 фунта или 250 г поваренной соли (NaCl).
- При ударах молнии образуется озон (O3) и укрепляется озоновый слой.
- Люди используют химию по крайней мере со времен Древнего Египта. К 1000 году до нашей эры человеческие цивилизации использовали передовые формы химии, такие как извлечение металлов из руды, ферментация спирта и очистка растительных экстрактов в качестве лекарств.
- ДНК не распространяет горение.
- Одно ведро воды содержит больше атомов, чем Атлантический океан — ведра воды.
- Если вы медленно налейте горсть соли в полностью полный стакан воды, она не переливается. Фактически уровень воды понизится.
- Хотя газообразный кислород бесцветен (не считая преломления света), и жидкая, и твердая формы имеют синий цвет.
- Один дюйм дождя равен 10 дюймам снега.
- У вас есть хеморецепторы (вкусовые рецепторы) на внутренней стороне щек.
- Плавиковая кислота настолько агрессивна, что растворяет стекло. Хотя фтористоводородная кислота вызывает коррозию, она считается «слабой кислотой».
- Примерно 20% кислорода в атмосфере производится тропическими лесами Амазонки.
- Единственные элементы, которые находятся в жидком состоянии при комнатной температуре, — это бром и ртуть.
- Галлий остается твердым при комнатной температуре, но в руке он становится жидким.
- Водород — самый распространенный элемент. Около 75% элементарной массы Вселенной составляет водород.
- Самый распространенный изотоп водорода — протий, с 1 протоном и 0 нейтронами.
- Самым твердым химическим веществом в вашем теле является зубная эмаль.
- Газ этилен, образующийся при созревании фруктов, позволяет созревать другие фрукты и овощи.
- Единственная буква, которой нет в Периодической таблице элементов, — это J. .
- В человеческом теле содержится достаточно углерода, чтобы произвести графит для примерно 9000 карандашей.
- Если вы выставите стакан с водой в космос, он скорее закипит, чем замерзнет. Водяной пар почти сразу кристаллизовался бы в лед.
- Кислород — самый распространенный элемент в земной коре, воде и атмосфере.
- Укусы пчел являются кислыми, а укусы осы щелочными.
- Комары любят запах эстрогена, поэтому женщины кусаются чаще, чем мужчины.
- Зажигалка была изобретена перед матчем.
А какой список полон без одной глупой шутки? Билли был сыном химика, но теперь его больше нет, то, что он считал h3O, было h3SO4!
У меня есть степень в области биологии, и мне нравится большинство ботаников и компьютерных фанатов.Я мама трех способных мальчиков и работаю с большинством детских организаций и мероприятий в моем районе. Я добровольно участвую в программе Head Start, чтобы преподавать дошкольники, обогащающие естественные науки, и стремлюсь пропагандировать научную грамотность всякий раз, когда кто-то позволяет мне говорить дольше, чем несколько секунд. Я люблю читать, шить, готовить, мастерить и писать, особенно когда я могу понять, как делать несколько из них одновременно (нет, друзья ботаники, мне никогда не удавалось читать и шить одновременно, но я буду продолжать вы разместили в погоне).
Спустя 150 лет периодическая таблица Менделеева содержит больше историй, чем элементов
Распознать эти строки и столбцы? Вы можете вспомнить пару деталей об устройстве этого могущественного стола из давних уроков химии. Элементы упорядочены в соответствии с их числом протонов или атомным номером. Металлы в основном слева, неметаллы — справа. В крайнем правом столбце указаны благородные газы, названные в честь их общего нежелания взаимодействовать с другими элементами.
Когда 150 лет назад Дмитрий Менделеев предложил свою периодическую таблицу, никто не знал, что находится внутри атома. Сегодня мы знаем, что место элемента на столе, наряду с его химическими свойствами, во многом связано с числом протонов элемента, а также с конфигурацией его электронов.
С одного взгляда вы можете увидеть элементы, которые составляют весь набор химических веществ, состоящий из
природных, а также то, как эти элементы соотносятся друг с другом. Но элементы тоже индивидуальны, с научными особенностями и подробными историями об открытиях.На этих страницах есть несколько наших любимых.
И таблица все еще в разработке. Четыре элемента были названы совсем недавно, в 2016 году. Исследования, нарушающие границы, остаются вместе с научными загадками.
Э. ОтвеллBanana bonanza
Калий
Бананы богаты калием-40, радиоактивной разновидностью калия. В одном банане калий-40 производит позитрон, антивещественную версию электрона, дюжину или около того раз в день, а также электрон примерно 13 раз в секунду.
Кто принадлежит
Лютеций, Лоуренсий, Лантан, Актиний
Не все уверены, что лютеций и лоуренсий занимают верхние позиции, показанные здесь. Вместо этого Королевское химическое общество помещает лантан и актиний в эти верхние ячейки, отдавая приоритет внешним электронным конфигурациям и прикрепляя лютеций и лоуренсий в конце f-блока. Международный союз теоретической и прикладной химии, ответственный за химическое обозначение, изучает вопрос о размещении с 2015 года.
Из лаборатории
Уран
Когда в 1896 году французский физик Анри Беккерель поместил соли урана на фотографические пластины, он случайно обнаружил радиоактивность, за что получил Нобелевскую премию по физике в 1903 году. Уран — последний элемент на столе, который встречается в сколько-нибудь значимом количестве в природа; остальное должно быть создано в лаборатории.
Специальный глянец
Золото
Специальная теория относительности Альберта Эйнштейна объясняет цвет золота.Из-за того, как уровни энергии электронов смещаются из-за теории относительности, металл поглощает синий свет, придавая отраженному свету желтый оттенок.
Прогнозирующая мощность
Галлий
Менделеев оставил пустые места в своей первоначальной таблице Менделеева, чтобы он мог правильно выстроить известные элементы. Галлий, элемент 31, был его первым пробелом, который был заполнен в 1875 году. Звезда популярного химического трюка, металлический галлий тверд при комнатной температуре, но жидкий при температуре выше 29.7 ° по Цельсию. Из него можно сделать ложку, которая тает в руке или в горячем чае.
Там
Гелий
Гелий был обнаружен в виде ярко-желтой линии в спектре солнечного света в 1868 году, почти за три десятилетия до того, как этот элемент был обнаружен на Земле.
 Всего 10% приходится на кожу.
Всего 10% приходится на кожу. Такое же количество данного вещества вырабатывается 25000-50000 га леса при фотосинтезе.
Такое же количество данного вещества вырабатывается 25000-50000 га леса при фотосинтезе. Через некоторое время из приготовленной смеси начали вылетать частицы черного цвета, и сама она, сильно увеличившись в объеме, так разогрелась, что начала светиться.
Через некоторое время из приготовленной смеси начали вылетать частицы черного цвета, и сама она, сильно увеличившись в объеме, так разогрелась, что начала светиться.